Нарушения морфофункционального состояния плаценты представляют собой одну из основных причин осложненного течения беременности и родов, а также перинатальной заболеваемости и смертности.
Патологические изменения, которые происходят при фетоплацентарной недостаточности (ФПН), приводят к:
- уменьшению маточно-плацентарного и фетоплацентарного кровотока;
- снижению артериального кровоснабжения плаценты и плода;
- ограничению газообмена и метаболизма в фетоплацентарном комплексе;
- нарушению процессов созревания плаценты;
- снижению синтеза и дисбалансу гормонов плаценты и их предшественников материнского и плодового происхождения.
Все эти изменения подавляют компенсаторно-приспособительные возможности системы мать — плацента — плод, замедляют рост и развитие плода, обусловливают осложненное течение беременности и родов (угроза преждевременного прерывания беременности, гестоз, преждевременные и запоздалые роды, аномалии родовой деятельности, преждевременная отслойка плаценты и др.).
Фетоплацентарная недостаточность представляет собой симптомокомплекс, при котором возникают морфофункциональные нарушения плода и плаценты вследствие различных экстрагенитальных и гинекологических заболеваний и акушерских осложнений.
Разнообразие вариантов проявления ФПН, частота и тяжесть осложнений для беременной и плода, преобладающее расстройство той или иной функции плаценты зависят от срока беременности, силы, длительности и характера воздействия повреждающих факторов, а также от стадии развития плода и плаценты, степени выраженности компенсаторно-приспособительных возможностей системы мать — плацента — плод.
Фетоплацентарная недостаточность. Причины и факторы риска
Фетоплацентарная недостаточность может развиваться под влиянием различных причин. Нарушения формирования и функции плаценты могут быть обусловлены заболеваниями сердца и сосудистой системы беременной (пороки сердца, недостаточность кровообращения, артериальная гипертензия и гипотензия), патологией почек, печени, легких, крови, хронической инфекцией, заболеваниями нейроэндокринной системы (сахарный диабет, гипо- и гиперфункция щитовидной железы, патология гипоталамуса и надпочечников) и целым рядом других патологических состояний.
ФПН при анемии обусловлена снижением уровня железа как в материнской крови, так и в самой плаценте, что приводит к угнетению активности дыхательных ферментов и транспорта железа к плоду.
При сахарном диабете нарушается метаболизм, выявляются гормональные расстройства и изменения иммунного статуса. Склеротическое поражение сосудов приводит к уменьшению притока артериальной крови к плаценте. На фоне данной патологии ФПН характеризуется замедленным или преждевременным созреванием плаценты с увеличением или уменьшением ее массы.
Важную роль в развитии ФПН играют различные инфекционные заболевания, особенно протекающие в острой форме или обостряющиеся во время беременности. Плацента может быть поражена бактериями, вирусами, простейшими и другими возбудителями инфекции. Наряду со специфическими воспалительными изменениями в плаценте отмечаются неспецифические реакции, характер которых зависит от времени и пути инфицирования.
Инфекционное поражение в I триместре нередко сопровождается прерыванием беременности. Инфицирование в более поздние сроки может быть ограничено локальными изменениями, которые зависят от характера возбудителя и пути его распространения.
Немаловажное значение в формировании ФПН играет патология матки: эндометриоз, гипоплазия миометрия, пороки развития матки (седловидная, двурогая).
Фактором риска ФПН следует считать миому матки. Однако риск ФПН у беременных с миомой матки различен. К группе с высоким риском относят первородящих в возрасте 36 лет и старше с преимущественно межмышечным расположением миоматозных узлов больших размеров, особенно при локализации плаценты в области расположения опухоли. При центрипетальном росте миомы, подслизистой и шеечной локализации узлов, а также при нарушении питания опухоли вероятность возникновения ФПН и нарушения развития плода приближается к 85 %.
Группу с низким риском ФПН составляют молодые женщины до 30 лет без тяжелых экстрагенитальных заболеваний, с небольшими миоматозными узлами преимущественно подбрюшинного расположения в дне и теле матки.
Среди осложнений беременности, наиболее часто сопутствующих ФПН, ведущее место занимает гестоз, что обусловлено известными патогенетическими механизмами и морфофункциональными изменениями в системе мать — плацента — плод, которые имеют место при данной патологии. Степень выраженности ФПН соответственно зависит от тяжести и длительности течения гестоза.
Угрозу прерывания беременности следует одновременно рассматривать и как причину, и как следствие ФПН. В связи с различной этиологией ФПН при угрозе прерывания беременности патогенез этого осложнения имеет различные варианты, а прогноз для плода зависит от степени развития защитно-приспособительных реакций.
При низком расположении или предлежании плаценты васкуляризация субплацентарной зоны снижена. Более тонкая стенка нижнего сегмента матки не обеспечивает необходимых условий для достаточной васкуляризации плацентарного ложа и его нормального функционирования. Относительно часто при данной патологии происходит отслойка плаценты, сопровождающаяся кровопотерей.
Многоплодная беременность представляет естественную модель ФПН в результате неадекватного обеспечения потребностей двух и более плодов.
В основе ФПН при изосерологической несовместимости крови матери и плода чаще всего лежат процессы нарушения созревания плаценты. У плода развиваются анемия и гипоксия, возникает задержка развития из-за нарушений процессов синтеза белка и снижения активности ферментов.
Увеличение частоты осложнений течения беременности при наличии рубца на матке определяется рядом факторов. Дистрофические изменения, происходящие в области рубца, оказывают влияние на иннервацию матки и приводят к патологической импульсации, что в свою очередь нарушает трофику и моторику передней стенки матки. Трофические изменения передней стенки матки нередко приводят к нарушению маточно-плацентарного кровообращения, особенно при локализации плаценты на передней стенке матки. Этим также объясняется увеличение частоты преждевременной отслойки плаценты, а также вероятности преждевременного прерывания беременности. Локализация плаценты на передней стенке матки резко ухудшает прогноз беременности, касающийся как состоятельности рубца, так и развития плода.
Функциональное состояние плаценты во многом обусловлено степенью ее развития в соответствии с гестационным сроком и сохранностью защитно-приспособительных механизмов. Соответствие зрелости плаценты гестационному сроку является одним из наиболее важных условий обеспечения адекватного развития плода и его защиты.
Несомненно, что поздний возраст беременной, отягощенный анамнез (аборты, воспалительные заболевания), вредные привычки, воздействие неблагоприятных факторов окружающей среды, плохое питание, социальная незащищенность и бытовая неустроенность также способствуют осложненному формированию плаценты и нарушению ее функции.
К факторам риска развития ФПН относят:
- возраст младше 17 лет и старше 35 лет;
- неблагоприятные социально-бытовые условия;
- токсическое и радиационное воздействие внешней среды;
- вредные пристрастия (алкоголь, курение, наркотики);
- инфекционные заболевания;
- экстрагенитальные заболевания (болезни сердечно-сосудистой системы, органов дыхания, печени, почек, крови, нервной системы, эндокринных органов, иммунной системы);
- гинекологические заболевания (воспалительной этиологии с нарушением нейроэндокринной регуляции менструальной функции, сопровождающиеся новообразованиями);
- неблагоприятный акушерско-гинекологический анамнез (бесплодие, привычное невынашивание, самопроизвольные и искусственные аборты, преждевременные роды, перенашивание беременности, мертворождение, полостные операции на органах малого таза, рубец на матке, выскабливание стенок матки, осложненное течение предыдущей беременности и родов);
- осложнения настоящей беременности (ранний токсикоз, многоплодная беременность, тазовое предлежание плода, аномальное расположение плаценты, гестоз, изосенсибилизация крови матери и плода).
Перечисленные факторы прежде всего приводят к нарушениям маточно-плацентарного, а далее и фетоплацентарного кровообращения. В силу происходящих изменений развиваются необратимые морфологические процессы и нарушаются основные функции плаценты.
Клиническая практика и результаты научных исследований свидетельствуют о многофакторной природе ФПН. В этой связи практически невозможно выделить какой-либо единственный фактор развития данного осложнения. Перечисленные патологические состояния не в одинаковой мере оказывают влияние на развитие ФПН. Чаще всего в развитии этой патологии участвуют несколько этиологических факторов, один из которых может быть ведущим.
Фетоплацентарная недостаточность. Патогенез
Знание основных звеньев патогенеза ФПН является фундаментом правильной диагностики, лечения и профилактики этого осложнения беременности.
В развитии ФПН можно выделить несколько взаимосвязанных патогенетических факторов:
- недостаточность инвазии цитотрофобласта;
- патологическое изменение маточно-плацентарного кровообращения;
- нарушение фетоплацентарного кровотока;
- незрелость ворсинчатого дерева;
- снижение защитно-приспособительных реакций;
- поражение плацентарного барьера.
Морфогенез плаценты во многом зависит от развития МПК. Согласно данным морфологических исследований, с 16—18-го дня наблюдается процесс инвазии интерстициального цитотрофобласта. На 5—6-й неделе процессы инвазии приобретают наиболее интенсивный характер с появлением клеток внутрисосудистого цитотрофобласта в просвете эндометриальных сегментов спиральных артерий. Первая волна инвазии цитотрофобласта способствует расширению и вскрытию спиральных артерий в межворсинчатое пространство, что обеспечивает начало и прирост МПК. К исходу 10-й недели на всей площади decidua basalis образуется система зияющих маточно-плацентарных артерий с широким просветом и постоянным кровотоком. Первая волна инвазии цитотрофобласта затухает в течение 11—14 нед.
На 16—18-й неделе беременности начинается вторая волна инвазии цитотрофобласта за счет миграции внутрисосудистого цитотрофобласта в глубь стенок миометральных сегментов спиральных артерий, что сопровождается разрушением эластомышечных компонентов сосудов и замещением их фибриноидом (рис. 1). В это же время наблюдается проникновение интерстициального цитотрофобласта в миометрий для активации изменений в сосудистой стенке со стороны адвентициальной оболочки.
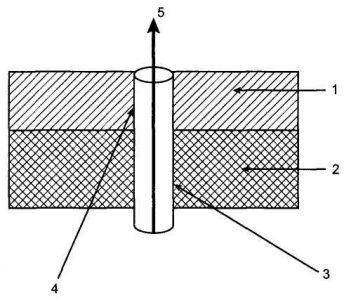
В результате деструкции мышечных элементов эндо- и миометральных сегментов спиральных артерий происходит значительное расширение их просвета и теряется способность отвечать на воздействие вазопрессорных факторов, что обеспечивает дальнейший прирост МПК.
Предполагается, что управляющую роль в этом сложном процессе выполняют децидуальные клетки, которые продуцируют местно-действующие регуляторы пролиферации и инвазии цитотрофобласта.
Происходящие изменения в стенках спиральных артерий следует рассматривать как адаптационный физиологический процесс, направленный на обеспечение непрерывного адекватного притока крови к межворсинчатому пространству.
Если к исходу I триместра беременности неполностью реализуется первая волна инвазии цитотрофобласта (сохраняются эластомышечные элементы эндометриальных сегментов спиральных артерий), то это приводит к значительному снижению объема притекающей материнской крови и задержке начала МПК. Образуются зоны некроза в decidua basalis, которые приводят к отслойке плаценты и смерти эмбриона.
Результаты многочисленных исследований плацентарного ложа во второй половине беременности при гестозе, гипертензии беременных, задержке развития плода свидетельствуют о том, что этим патологическим состояниям часто предшествует недостаточность второй волны инвазии цитотрофобласта в миометральные сегменты спиральных артерий. Сосуды сохраняют эндотелий, среднюю оболочку и эластические мембраны. Узкий просвет спиральных артерий, их резистентность и чувствительность к сосудодвигательным раздражителям препятствует нормальному кровотоку, не обеспечивает адекватного прироста МПК, приводит к уменьшению кровоснабжения плаценты и ишемии ворсин.
Возможно, артериальная гипертензия, связанная с беременностью, развивается как компенсаторная реакция, которая направлена на усиление притока крови в межворсинчатое пространство в ответ на недостаточность второй волны инвазии цитотрофобласта.
Нарушение кровотока в спиральных артериях сопровождается также геморрагическими нарушениями и в межворсинчатом пространстве. Патология спиральных артерий может привести как к преждевременной отслойке плаценты, так и к ее острому геморрагическому инфаркту.
Одним из ведущих факторов патогенеза ФПН является нарушение маточно-плацентарного кровообращения, в основе которого заложены морфофункциональные изменения сосудистой системы и отдельных ее компонентов, причем особое значение отведено расстройствам в бассейне спиральных артерий и в межворсинчатом пространстве.
К 10—12-й неделе физиологически протекающей беременности заканчивается период плацентации, который характеризуется васкуляризацией ворсин и превращением вторичных ворсин в третичные. Основной структурной единицей плаценты становится котиледон, который образован стволовой ворсиной с разветвлениями, содержащими сосуды плода. Центральная часть котиледона образует полость, которая окружена ворсинами второго и третьего порядка. В зрелой плаценте насчитывается от 30 до 50.
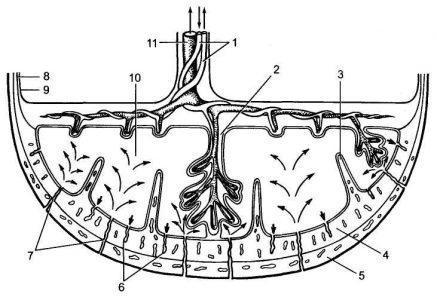
Межворсинчатое пространство с плодовой стороны образовано хориальной пластинкой и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластинкой, децидуальной оболочкой и отходящими от нее септами (рис. 2).
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих матку, открываются в межворсинчатое пространство 120—150 устьями. В результате гестационной перестройки спиральных артерий обеспечивается постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство.
За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, достигает хориальной пластинки и по разделительным септам возвращается в материнский кровоток через венозные устья.
Густая сеть терминальных и промежуточных ворсин образует капиллярное звено МПК, где через плацентарный барьер происходит диффузия газов и обмен питательных веществ между кровью матери и плода.
Отток крови из межворсинчатого пространства происходит через венозные устья, большинство из которых расположено вблизи септ, разделяющих котиледоны. Венозные устья и коллекторы не подвергаются гестационной перестройке, сохраняют эндотелиальную выстилку и отдельные гладкомышечные клетки.
Вены плацентарного ложа из верхней части тела матки переходят в гроздевидное сплетение, а из нижней части — в систему маточной вены, образуя многочисленные анастомозы.
На фоне сохранения мышечных элементов в стенках сосудов субплацентарной зоны, полной или частичной обтурации сосудов из-за атеросклеротических изменений, расстройства сосудисто-тромбоцитарного звена, тромбоза или микроэмболии происходят нарушения в сосудистой системе матки, межворсинчатом пространстве, сосудах плаценты и пуповины.
Следует принимать во внимание, что система кровоснабжения матки является лишь частью общей системы кровообращения организма женщины. Исходя из этого, патология МПК может расцениваться как одно из регионарных проявлений дезадаптации материнского организма и регуляторных механизмов сердечно-сосудистой системы (вегетативная нервная система, система ренин — ангиотензин, серотонин, брадикинин, катехоламины, простагландины и др.), которые изменяют тонус сосудов и реологические свойства крови.
Нарушение кровотока в отдельных сосудах не всегда приводит к значительному уменьшению кровоснабжения плаценты, так как оно компенсируется за счет коллатерального кровотока. Если коллатеральное кровообращение выражено недостаточно, то развиваются нарушения микроциркуляции, ишемия и дегенерация участков плаценты.
Нарушение МПК характеризуется следующими важнейшими факторами:
- снижением притока к межворсинчатому пространству;
- затруднением оттока из межворсинчатого пространства;
- изменениями реологических и коагуляционных свойств крови матери и плода;
- расстройством капиллярного кровотока в ворсинах хориона.
Безусловно, что наиболее важной, но не единственной причиной снижения притока крови в межворсинчатое пространство является отсутствие гестационной перестройки миометральных сегментов спиральных артерий в результате недостаточности второй волны инвазии цитотрофобласта.
Определенную роль в уменьшении интенсивности кровотока в маточно-плацентарных сосудах играют гиповолемия (возникающая у беременных при гестозе), артериальная гипотензия или низкая локализация плаценты (нижний сегмент, предлежание плаценты).
Пороки сердца у беременных и снижение сократительной активности миокарда также приводят к уменьшению притока крови к матке. Анемия беременных способствует редукции газообмена и оксигенации крови плода.
Снижение МПК оказывает серьезное влияние на формирование ФПН в связи с тем что уровень газообмена обусловлен в большей степени скоростью кровотока, чем диффузионными свойствами плаценты. Следовательно, замедление кровотока в спиральных артериях и межворсинчатом пространстве неизменно приводит к снижению газообмена между кровью матери и плода.
Нарушение оттока крови из межворсинчатого пространства отмечается при сердечно-сосудистых и легочных заболеваниях, при гипертонусе и повышенной сократительной активности матки. Во время сокращений матки значительно увеличивается давление в миометрии, амниотической полости и в межворсинчатом пространстве. При этом в маточно-плацентарных артериях давление крови существенно не изменяется, а венозный отток практически прекращается. На этом фоне происходит дальнейшее увеличение давления и существенное замедление циркуляции крови в межворсинчатом пространстве. Последующее возрастание давления в межворсинчатом пространстве до уровня, превышающего системное артериальное давление, служит препятствием для поступления крови по спиральным артериям (ишемия плаценты).
Таким образом, нарушение оттока и притока крови вызывает резкое снижение гемоциркуляции в межворсинчатом пространстве и уменьшение газообмена между кровью матери и плода.
Снижение скорости кровотока в межворсинчатом пространстве, особенно в сочетании с нарушением синтеза и баланса простагландинов Е2 и F2α, простациклина и тромбоксана А2, приводит к тромбообразованию, гиперкоагуляции, повышению вязкости крови, отложению фибрина, снижению микроциркуляции и развитию нодулярной ишемии.
Существенная роль в развитии ФПН отведена нарушению фетоплацентарного кровотока. Артериальная система ФПК, несущая венозную кровь от плода к плаценте, представлена двумя артериями пуповины, которые берут начало от общих подвздошных артерий плода. Конечными ветвями пуповинных артерий являются артерии и артериолы ворсин I, II и III порядка. Стенка артерий пуповины включает в себя два мышечных слоя: – наружный с циркулярным расположением мышечных пучков и внутренний с продольным их направлением.
Продолжением артериол являются многочисленные извитые капилляры в составе терминальных ворсин. На верхушках терминальных ворсин капилляры расширяются, образуя синусоиды, которые располагаются под истонченным синцитиотрофобластом и формируют плацентарный барьер.
От капиллярных петель на уровне промежуточных дифференцированных ворсин берет начало венозное звено ФПК. Далее от оснований опорных ворсин венозные сосуды (несут насыщенную кислородом кровь) направляются в толщу хориальной пластинки и сливаются в единую вену пуповины, представляющую собой мощный сосуд эластомышечного типа, переходящий в венозный проток в области печени плода.
Кровоток в пуповине и плаценте осуществляется за счет сократительной деятельности сердца плода, которое обладает ограниченными возможностями увеличения сердечного выброса. Важным фактором кровотока является также наличие гладкомышечных слоев в стенках артерий пуповины, выполняющих роль «дополнительного», или «периферического сердца».
Одним из механизмов возврата крови из плаценты к плоду является гравитационная разница в позиции плаценты и плода (плацента находится выше или на одном уровне с сердцем плода), которая способствует оттоку крови по пуповине.
Кроме того, ритмичная пульсация артерий пуповины, обвивающих вену, передается на ее стенки через эластичный вартонов студень, что также способствует оттоку крови. Вена пуповины обладает собственной сократительной способностью, так как строение ее мышечной оболочки и внутренней эластичной мембраны напоминает структуру артерий эластомышечного типа у взрослого человека.
Автономная регуляция ФПК обеспечивается сосудорасширяющим и сосудосуживающим влиянием местно-гуморальных факторов, вырабатываемых в плаценте или в организме плода. Сосудорасширяющее влияние оказывают простациклин и эндотелиальный натрийуретический пептид, которые вырабатываются эндотелиальными клетками. Роль вазоконстрикторов выполняют тромбоксан А2, ангиотензин II и эндотелии I.
При доминирующем нарушении ФПК отмечается снижение кровообращения в артериях пуповины, хориальной пластинки и опорных ворсин, что сопровождается картиной облитерационной ангиопатии. В большинстве наблюдений выявлены нормальные гестационные изменения спиральных артерий. Более чем в половине наблюдений имеет место патологическая незрелость ворсин. В результате воздействия местных сосудосуживающих факторов наблюдается сужение просвета пупочных артерий. Развивается облитерация артерий и артериол в опорных ворсинах и снижается капиллярный кровоток. В результате гипоксии и активизации ворсинчатого цитотрофобласта дистально расположенные ворсины полностью замуровываются фибриноидом, что является следствием первичного прекращения кровообращения в их капиллярах. Выключение замурованных фибриноидом ворсин из межворсинчатого кровотока приводит к нарушению газообмена, расстройству функции плаценты и развитию ФПН.
Одной из важных причин расстройства функции плаценты и развития ФПН является незрелость ворсинчатого дерева, которая проявляется изменениями всех ее структурных единиц.
Выделяют несколько вариантов патологической и относительной незрелости плаценты:
▲ Вариант незрелых мезенхимальных ворсин представляет собой самую раннюю форму незрелости плаценты, которая развивается в результате антенатальных повреждений в стадии вторичных или мезенхимальных ворсин. Остановка развития ворсин характеризуется отсутствием дальнейшей дифференцировки мезенхимы в направлении аутохтонного ангиогенеза и других компонентов стромы.
▲ Вариант эмбриональных ворсин обусловлен персистенцией регрессирующих ворсин. Ранняя патологическая незрелость формируется в результате антенатального повреждения в промежутке от 21—22 дней до 7—8 нед.
При этом в ворсинах из капилляров не образуются артериолы и венулы, что может быть вызвано несоответствием начавшегося ангиогенеза в ворсинах с темпами формирования кровеносной системы эмбриона или слияния сосудов развивающейся пуповины с ворсинчатым деревом. Негативное влияние может также проявиться вследствие несостоятельности первой волны инвазии цитотрофобласта, которая имеет место в это же время.
В составе плаценты встречается 50—60 % эмбриональных ворсин при раннем токсикозе, изосерологической несовместимости крови матери и плода, сахарном диабете, инфекциях (токсоплазмоз, краснуха, сифилис).
▲ Вариант промежуточных незрелых ворсин характеризуется тем, что при антенатальном повреждении в промежутке от 8—9 до 16—18 нед происходит персистенция промежуточных незрелых ворсин, сохраняющих морфофункциональную активность. Основным патогенетическим механизмом развития этого варианта незрелости плаценты является недостаточность второй волны инвазии цитотрофобласта в миометральные сегменты спиральных артерий. Отсутствие дальнейшего роста объема МПК приводит к тому, что ворсинчатое дерево к середине беременности не способно адекватно реализовать свои диффузионные возможности.
Вариант промежуточных незрелых ворсин встречается при раннем антенатальном инфицировании, сахарном диабете, нефритах и другой соматической патологии у беременной.
▲ Вариант промежуточных дифференцированных ворсин проявляется персистенцией ворсинчатого дерева без образования терминальных ворсин в результате антенатального повреждения на 21—32-й неделе, когда в норме происходит интенсивный рост промежуточных ветвей. Морфологические особенности строения промежуточных дифференцированных ворсин приводят к уменьшению диффузионной поверхности ворсинчатого дерева, площади гормонобразующего синцитиотрофобласта и объема межворсинчатого пространства. Чаще всего на этом фоне отмечается ЗВУР плода.
▲ Вариант хаотичных склерозированных ворсин формируется в результате антенатальных повреждений на 25—30-й неделе и характеризуется нарушением формирования мелких ворсин с преобладанием стромального компонента, отставанием развития капиллярного русла и эпителиального покрова. Отмечается беспорядочное ветвление мелких ворсин с единичными узкими капиллярами, которые по своему строению не соответствуют типичным терминальным ветвям.
Вариант хаотичных склерозированных ворсин часто встречается при тяжелой форме гестоза, артериальной гипертензии, многоплодной беременности.
Перечисленные варианты патологической незрелости плаценты чаще всего приводят к смерти плода или к задержке его внутриутробного развития.
Выделяют также две формы относительной незрелости плаценты.
▲ Преждевременное созревание плаценты обусловлено появлением преобладающего числа типичных терминальных ворсин ранее 32— 33 нед. Большинство из этих ворсин не соответствует специализированному типу терминальных ворсин, которые образуются в течение последнего месяца беременности.
▲ Диссоциированное развитие котиледонов характеризуется наличием зон промежуточных дифференцированных или незрелых ворсин, а также отдельных групп эмбриональных ворсин наряду с преобладанием нормальных терминальных ворсин, соответствующих гестационному сроку.
Неравномерное созревание котиледонов часто наблюдается при гестозе. Следовательно, характер процессов созревания плаценты тесно взаимосвязан с различной акушерской патологией.
В патогенезе ФПН существенная роль отводится снижению активности защитно-приспособительных реакций в системе мать — плацента — плод в ответ на патологический процесс.
При физиологически протекающей беременности эти реакции направлены на оптимальное поддержание функции фетоплацентарного комплекса. Степень выраженности ФПН во многом определяется сохранностью защитно-приспособительных реакций и нормальной структурой плаценты.
Нормальный газообмен между организмом матери и плода обеспечивается адекватным состоянием МПК и ФПК.
Примером компенсаторной реакции со стороны материнского организма является увеличение минутного объема сердца и ОЦК, а также снижение сосудистого сопротивления в маточных артериях.
Даже при нормально протекающей беременности количество поступающего кислорода в организм плода ниже, чем у взрослого человека. Этот дефицит успешно компенсируется различными приспособительными механизмами, что обеспечивает нормальное развитие плода.
Одним из таких приспособительных механизмов является высокий сердечный выброс у плода (в 3—4 раза больше, чем у взрослого человека из расчета на 1 кг массы). Уровень гемоглобина в крови матери составляет около 120 г/л, а в крови плода около 150 г/л. Каждый грамм гемоглобина соединяется с 1,34 мл кислорода. Такое увеличение способности крови к переносу кислорода наряду с повышением сродства крови плода к кислороду содействует оптимизации его перехода из материнского в плодовый кровоток. Наличие анатомических плодовых шунтов (венозный проток, артериальный проток, овальное окно) способствует тому, что почти во все органы плода поступает смешанная кровь. В этом случае падение парциального давления кислорода при гипоксии происходит более медленно.
К компенсаторным реакциям, обеспечивающим устойчивость плода к гипоксии, относят также низкий уровень его метаболизма и высокую активность гликолиза.
Компенсаторные реакции со стороны плаценты проявляются расширением просвета плодных сосудов. За счет увеличения количества терминальных ворсин повышается общая обменная площадь плаценты для обеспечения достаточного насыщения крови плода кислородом.
Важнейшим компенсаторным механизмом второй половины беременности является образование синцитиокапиллярных мембран, через которые осуществляется газообмен и транспорт питательных веществ.
При недостаточном газообмене в качестве компенсаторной реакции повышается активность анаэробных процессов метаболизма, направленная на нормализацию нарушений кислородного обмена между матерью и плодом, снижается потребление кислорода плацентой и тканями плода.
Оптимизация МПК обеспечивается за счет формирования миометральных и плацентарных артериовенозных шунтов.
Под действием повреждающих этиологических факторов, способствующих развитию ФПН, перечисленные компенсаторные реакции могут носить неполноценный характер. Резерв проявления защитно-приспособительных реакций имеет определенный предел, после которого наступают необратимые патологические сдвиги в фетоплацентарном комплексе, приводящие к декомпенсированной форме ФПН, включая смерть плода.
Поражение плацентарного барьера под влиянием патологических факторов также относят к одному из патогенетических механизмов развития ФПН.
Плацентарный барьер, состоящий из эпителиального покрова ворсин, общего базального слоя синцититрофобласта и эндотелиоцита прилежащего капилляра, а также цитоплазматического слоя эндотелиоцита, осуществляет функциональное взаимодействие между МПК и ФПК (рис. 10.3). Строение плацентарного барьера обеспечивает интенсивный газообмен и транспорт питательных веществ между материнским и плодовым кровотоком.
Функционирует несколько путей транспорта веществ через плацентарный барьер.
▲ Диффузия обеспечивает перемещение газов, липидов, жирорастворимых витаминов и некоторых лекарств через мембраны из области их высокой концентрации в область более низкой за счет движения молекул.
▲ Облегченная диффузия осуществляет транспорт углеводов и аминокислот. Особые молекулы-носители захватывают эти вещества из плазмы крови матери (область высокой концентрации) и переносят их через плацентарный барьер в плодовый кровоток (область низкой концентрации).
▲ Активный транспорт позволяет переносить вещества в противоположном концентрационному градиенту направлении. Такой вид транспорта реализуется с потреблением энергии, так как переносимые этим путем аминокислоты, белки, витамины и микроэлементы (кальций, железо и др.) предварительно подвергаются в цитоплазме синцитиотрофобласта и эндотелиоцита определенным химическим реакциям и перемещаются через плацентарный барьер с помощью молекул-носителей.
▲ Пиноцитоз способствует продвижению через плацентарный барьер белков плазмы, иммуноглобулинов и гормонов. Механизм пиноцитоза заключается в том, что образующиеся мембранные инвагинации захватывают переносимые вещества и трансформируются в пузырьки, которые перемещаются через все слои плацентарного барьера и вскрываются на его противоположной стороне.
▲ Дефекты плацентарной мембраны позволяют перемещаться через плацентарный барьер материнским и плодовым клеткам крови, а также возбудителям некоторых инфекций.
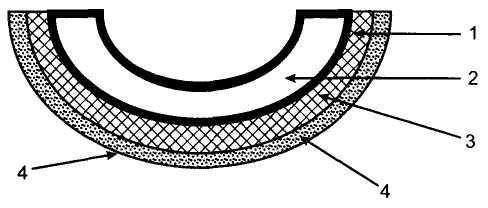
▲ Объемный перенос веществ осуществляется за счет гидростатического или осмотического градиента. Таким способом перемещается вода и растворенные электролиты.
На регуляцию проницаемости плацентарного барьера оказывают влияние ряд ферментов. Проницаемость клеточных мембран обусловлена также равновесием между перекисным окислением липидов (ПОЛ) и системой антиоксидантной защиты в организме матери и плода. При развитии ФПН в результате нарушения обмена углеводов и липидов усиливается ПОЛ на фоне снижения антиоксидантной активности, что является одной из важных причин повреждения клеточных мембран плаценты и нарушения их проницаемости.
В результате действия повреждающих факторов в I—II триместре развитие ФПН может быть обусловлено преобладающим поражением плацентарного барьера.
При этом наблюдаются наиболее тяжелые варианты незрелости ворсин с прогрессирующим склерозом стромы. Отмечается выраженное снижение кровотока в капиллярном русле плаценты (нарушение ФПК) при относительной сохранности МПК, что приводит к развитию местной гипоксии. Более чем в половине наблюдений отмечена нормальная гестационная перестройка спиральных артерий. Отличительным гистологическим признаком данного варианта развития ФПН является атрофия синцититрофобласта и выраженное утолщение плацентарного барьера, что приводит к нарушению его транспортной функции.
Ведущая роль тех или иных патогенетических механизмов в развитии ФПН во многом обусловлена ее этиологическими факторами.
При гестозе и гипертонической болезни на первый план выступают изменения МПК и микроциркуляции. Иммунологический конфликт изначально проявляется нарушением проницаемости клеточных мембран, и лишь вторично развиваются циркуляторные и другие расстройства.
При беременности, осложненной гормональными расстройствами, первичным звеном ФПН является снижение васкуляризации хориона.
В результате воздействия повреждающих факторов и реализации патогенетических механизмов, приводящих к ФПН, закономерно развивается гипоксия плода.
Чаще всего (по механизму развития) наблюдается артериально-гипоксемическая и смешанная форма гипоксии вследствие снижения содержания кислорода в крови матери, уменьшения МПК, нарушения транспортной функции плацентарного барьера, изменения реологических свойств крови, анемии, аномалий развития плода и также целого ряда других причин.
На начальных этапах развития гипоксии у плода активизируются вазопрессорные факторы, повышается тонус периферических сосудов, отмечается тахикардия, увеличивается частота дыхательных движений, повышается двигательная активность, возрастает минутный объем сердца.
Дальнейшее прогрессирование гипоксии приводит к смене тахикардии на брадикардию, появляется аритмия, уменьшается минутный объем сердца. Адаптационной реакцией на гипоксию является перераспределение крови в пользу мозга, сердца и надпочечников с одновременным уменьшением кровоснабжения остальных органов. Параллельно угнетается двигательная и дыхательная активность плода. Вследствие избыточного накопления в организме плода углекислого газа и развития метаболических нарушений у плода отмечаются:
- патологический ацидоз;
- гипергликемия;
- снижение окислительной и пластической роли глюкозы;
- истощение запасов гликогена и липидов;
- энергетическая недостаточность;
- нарушение гормональных механизмов регуляции;
- дисбаланс электролитов;
- задержка развития.
Характер и тяжесть поражения органов и тканей плода зависят от длительности и выраженности гипоксии, а также от эффективности реализации его защитно-приспособительных реакций.
Фетоплацентарная недостаточность. Морфофункциональные нарушения в плаценте
Патоморфологическая картина плаценты при ФПН характеризуется прежде всего дегенеративно-дистрофическими изменениями, нарушением МПК, изменением проницаемости стромы ворсин, признаками нарушения созревания ворсин и целым рядом других явлений. При этом выраженность патологических изменений зависит от степени тяжести и длительности течения осложнения и характера компенсаторно-приспособительных реакций.
Нередко развитие ФПН сопровождается уменьшением параметров плаценты (масса, объем, площадь материнской поверхности), что свидетельствует о нарушении ее компенсаторных возможностей. Уменьшение массы плаценты обусловлено прежде всего нарушением ее белковообразующей функции. Чаще, чем в норме, встречается эксцентричное или оболочечное прикрепление пуповины. Количество вартонова студня в пуповине уменьшается, теряется эластичность пуповины, уплотняются стенки ее сосудов, обнаруживаются ложные узлы, представляющие собой варикозно-расширенные вены.
Среди патоморфологических изменений, происходящих в плаценте при ФПН, отмечаются инфаркты, отложения фибриноида со стороны межворсинчатого пространства, фибриноидное перерождение эпителия ворсин, стромы и стенок сосудов, коллагенизация стромы, уменьшение количества кровеносных сосудов в стволовых и терминальных ворсинах, редукция объема межворсинчатого пространства, увеличение симпластических почек с признаками дистрофии, морфологическая незрелость плаценты, доминирование промежуточных ворсин и диссоциированное развитие котиледонов.
Происхождение инфарктов в плаценте обусловлено прежде всего тромбозом сосудов ворсин и хориальной пластинки с последующей ишемией стромы и отложением фибриноида. Пропорционально степени выраженности ФПН уменьшается количество терминальных ворсин, выявляются их гипоплазия, неправильное расположение в межворсинчатом пространстве, конгломерация, окутывание фибриноидом. Одновременно снижается площадь просвета капилляров ворсин, их объем и количество.
В эпителии промежуточных ворсин выявляются дистрофические изменения. Участки десквамации и истончения эпителия чередуются с участками гиперплазии и образовавшимися синцитиальными узлами, которые представляют собой скопления ядер синцитиотрофобласта. При нарастании тяжести ФПН пропорционально увеличивается количество незрелых ворсин. При выраженной ФПН в строме терминальных ворсин наряду с отеком обнаруживаются процессы очагового фибриноидного некроза. Увеличивается количество склерозированных терминальных ворсин.
На циркуляторные нарушения, происходящие при ФПН, указывает тромбоз капилляров. Имеют место также кровоизлияния, отек стромы ворсин, инфаркты, межворсинчатые тромбы.
При нарушении МПК обнаруживаются изменения сосудов, характеризующиеся набуханием клеток эндотелия капилляров, артерий и венул. В сосудах стволовых ворсин отмечается концентрическая пролиферация с отслоением эндотелиальных клеток. В стенках артерий выявляются выраженные дистрофические изменения, набухание, разволокнение структур, очаговая пролиферация клеток эндотелия, приводящая к стенозу просвета. При выраженной ФПН вокруг стенок артерий и артериол в стволовых ворсинах обнаруживается лимфолейкоцитарная инфильтрация, как правило, сопровождающаяся сужением сосудов.
За счет застоя крови, повышенного отложения фибриноида, образования петрификатов и инфарктов ворсин происходит уменьшение объема межворсинчатого пространства, что влечет за собой нарушение гемодинамики. При нарастании степени тяжести ФПН клетки цитотрофобласта подвергаются тяжелым дистрофическим изменениям (лизис, деструкция цитоплазматических и ядерных мембран, отек и фибриноидное перерождение).
Происходящие патоморфологические нарушения тесно взаимосвязаны с изменениями функций плаценты.
Снижение транспортной функции плаценты при ФПН обусловлено уменьшением ее васкуляризации, большой рассеянностью сосудов, а также уменьшением их удельного объема и площади сосудов терминальных ворсин.
Угнетение газообмена сопровождается снижением числа синцитиокапиллярных мембран.
Состояние хориального эпителия и функционально активных симпластических почек является морфологическим эквивалентом интенсивности обмена веществ в плаценте и транспортировки метаболитов через плацентарный барьер. В зависимости от степени выраженности ФПН количество ворсин с симпластическими почками уменьшается в 1,5—4 раза.
Одним из наиболее важных структурных компонентов, отражающих гормональную функцию плаценты, является трофобласт. При нарастании тяжести ФПН удельный объем цитотрофобласта снижается.
Барьерную функцию плаценты обеспечивают широкий слой хориального эпителия, центральное расположение кровеносных сосудов в ворсинах, интерстициальная ткань. В зависимости от тяжести ФПН в плаценте увеличивается количество хориальных ворсин с фибриноидом. Чрезмерное отложение фибриноида на поверхности ворсин и в строме ворсинчатого хориона уменьшает их активную поверхность, что создает неблагоприятные условия для питания и газообмена плода.
Несмотря на инволютивно-дистрофические и циркуляторные нарушения в плаценте, которые развиваются при ФПН, параллельно проявляются и защитно-приспособительные изменения, к которым относятся гиперплазия терминальных ворсин и капилляров; увеличение их количества, расширение просвета, смещение капилляров к ба-зальной мембране, образование и увеличение синцитиокапиллярных мембран, нарастание количества синцитиальных почек, что приводит к увеличению обменной поверхности между кровотоком матери и плода. Компенсаторные реакции трофобласта проявляются пролиферацией хориального эпителия, что обеспечивает увеличение полезной площади плодовой части плаценты.
В связи с выключением ряда участков плаценты из кровотока при циркуляторных нарушениях в качестве адаптационной реакции увеличивается количество мелких терминальных ворсин и цитотрофобластических элементов.
Компенсаторные реакции, наблюдаемые в микроциркуляторном русле и хориальном эпителии при ФПН, носят неспецифический характер и реализуются с помощью механизмов, выработанных в процессе эволюции и онтогенеза. Плацента является многофункциональным органом, морфологическое строение которого обеспечивает выполнение одними и теми же структурами различных функций. Благодаря этой особенности при развитии компенсаторно-приспособительных реакций повышение эффективности одной функции может приводить к снижению эффективности другой.
Реализации компенсаторно -приспособительных реакций на тканевом уровне препятствует также нарушение созревания хориона. При этом на фоне зрелых терминальных ворсин обнаруживаются группы ворсин с рыхлой стромой и слабо развитой сосудистой сетью. Диссоциированное созревание ворсин является типичным морфологическим признаком хронической ФПН.
Декомпенсированной форме ФПН сопутствует увеличение количества ворсин с субэпителиальным расположением сосудов, что следует рассматривать как истощение функциональных резервов фетоплацентарного комплекса. В плаценте выявляются инфаркты, массивные отложения фибриноида в области базальной пластинки и плодовой части плаценты, коллагенизация стромы, сужение межворсинчатых пространств, увеличение количества синцитиальных узелков с признаками дистрофии.
При этом, как правило, отмечается большой объем нефункционирующих зон, состоящих из склеенных ворсин, материнского фибриноида, кальцификатов. Часто выявляются выраженные геморрагические нарушения в виде кровоизлияний различной давности в межворсинчатом пространстве. В большинстве мелких концевых ворсин, бедных сосудами, строма пронизана густой сетью коллагеновых волокон. Отдельные группы концевых ворсин вблизи базальной пластинки и в плодовой части плаценты окружены массивным слоем фибриноида, при этом часть из них находится в состоянии некробиоза и некроза.
Фетоплацентарная недостаточность. Классификация
С учетом времени начала по отношению к срокам формирования плаценты выделяют первичную и вторичную ФПН.
Первичная ФПН развивается в ранние сроки беременности (до 16 нед) в период имплантации, на ранних этапах развития плаценты и эмбриогенеза, под влиянием генетических, эндокринных, инфекционных факторов, воздействия окружающей среды и др. На формирование первичной ФПН оказывают влияние предшествующие настоящей беременности нейроэндокринные нарушения, недостаточность децидуальных изменений, воспалительные и инфекционные заболевания.
В качестве начального звена в развитии первичной ФПН чаще всего выступают недостаточность инвазии цитотрофобласта, нарушение МПК, некоторые варианты незрелости ворсин. Возникает неполноценность васкуляризации и развития хориального дерева, отставание в формировании котиледонов, что приводит к снижению функциональной способности плаценты. Дальнейшее развитие беременности характеризуется замедлением созревания ворсин, задержкой и диссоциацией в их развитии. Из-за наличия незрелых терминальных ворсин осуществляется неполноценный метаболизм и снижается синтез гормонов.
Вторичная ФПН развивается уже при сформировавшейся плаценте под влиянием исходящих от матери факторов или вследствие осложненного течения беременности. В генезе вторичной ФПН важную роль играют экстрагенитальные заболевания и осложнения беременности.
Основными звеньями в патогенезе ФПН являются нарушения МПК и ФПК, недостаточность второй волны инвазии цитотрофобласта, патологическая незрелость ворсин, нарушения защитно-приспособительных реакций.
По клиническому течению ФПН подразделяют на острую и хроническую.
Острая ФПН может возникнуть в любой срок беременности и во время родов. Прежде всего она проявляется нарушением газообменной функции плаценты и приводит к острой гипоксии плода, которая часто заканчивается его смертью. В развитии острой ФПН ведущая роль отводится нарушениям МПК и ФПК. Наиболее часто это осложнение возникает при преждевременной отслойке плаценты, тромбозе субхориальной зоны, кровоизлияниях в краевых синусах, на фоне истинных инфарктов плаценты и тромбоза ее сосудов.
Хроническая ФПН развивается чаще, чем острая. Проявление хронической ФПН во II триместре с последующим длительным течением нередко представляет собой продолжение первичной плацентарной недостаточности.
Однако наиболее часто хроническая ФПН по времени начала носит вторичный характер и ее течение определяется соответствующими патогенетическими механизмами.
ФПН следует рассматривать не только с позиций тех морфофункциональных изменений в плаценте, которые встречаются при осложненном течении беременности и экстрагенитальных заболеваниях. Необходимо также учитывать степень выраженности и сохранности защитно-приспособительных реакций в системе мать — плацента — плод. В этой связи хроническую ФПН целесообразно классифицировать с учетом состояния защитно-приспособительных реакций.
При изменениях структуры и функции плаценты, вызванных той или иной патологией, на начальном этапе ФПН защитно-приспособительные реакции (которые имеют место при нормальном развитии беременности) усиливаются и возникают новые, что обеспечивает на определенный период функциональную активность фетоплацентарного комплекса. Под действием одного или нескольких патологических факторов происходит умеренная активация всех функций плаценты и может временно прекратиться прогрессирование ФПН. При этом нарушений развития плода может и не быть, так как «здоровые» участки плаценты компенсируют начавшуюся патологию. Рост плода соответствует гестационному сроку, а масса тела новорожденного находится в пределах нормы.
Дальнейшее прогрессирование беременности поддерживается компенсаторными реакциями, действующими на тканевом уровне за счет увеличения числа резорбционных ворсин, капилляров терминальных ворсин, функционирующих синцитиальных узелков. На фоне длительного, усиливающегося или повторного действия патологических факторов происходит чрезмерная активация функций плаценты, приводящая к выраженному перенапряжению компенсаторных механизмов, что способствует их последующему угнетению и дезорганизации основных функций плаценты. Происходит существенное снижение защитно-приспособительных реакций и их последующий срыв, что обусловлено нарушениями созревания хориона и выраженными морфо-функциональными изменениями в плаценте.
Таким образом, классификация хронической ФПН в зависимости от состояния защитно-приспособительных реакций представляется следующим образом.
▲ Компенсированная форма ФПН, при которой имеют место начальные проявления патологического процесса в фетоплацентарном комплексе. Защитно-приспособительные механизмы активизируются и испытывают определенное напряжение, что создает условия для дальнейшего развития плода и прогрессирования беременности. При адекватной терапии и правильном ведении родов возможно рождение здорового ребенка.
▲ Субкомпенсированная форма ФПН характеризуется усугублением тяжести осложнения. Защитно-приспособительные механизмы испытывают предельное напряжение (возможности фетоплацентарного комплекса при этом практически исчерпаны), что не позволяет обеспечить их реализацию в достаточной степени для адекватного течения беременности и развития плода. Увеличивается риск возникновения осложнений для плода и новорожденного.
▲ Декомпенсированная форма ФПН. Имеют место перенапряжение и срыв компенсаторно-приспособительных механизмов, которые уже не обеспечивают необходимых условий для дальнейшего нормального прогрессирования беременности. В фетоплацентарной системе происходят необратимые морфофункциональные нарушения. Существенно возрастает риск развития тяжелых осложнений для плода и новорожденного (включая их смерть).
▲ Критическая форма ФПН— крайнее, максимально выраженное проявление необратимых морфофункциональных нарушений фетоплацентарного комплекса, которые чаще всего влекут за собой смерть плода.
Такая градация ФПН позволяет более дифференцированно оценивать формы данной патологии с учетом ее полиэтиологичности и разнообразия механизмов патогенеза.
Фетоплацентарная недостаточность. Клиническая картина
Клинические признаки первичной ФПН проявляются прежде всего угрозой прерывания беременности, начавшимся самопроизвольным выкидышем или абортом в ходу. Возможны неразвивающаяся беременность, формирование врожденных пороков развития плода, аномальное расположение плаценты.
В более поздние сроки (III триместр беременности) в целом ряде наблюдений отмечаются признаки нарушения развития и состояния плода (задержка развития).
Наиболее яркое проявление острой ФПН— гипоксия плода в связи с нарушением дыхательной и транспортной функций плаценты. Степень тяжести состояния плода зависит от величины пораженного участка плаценты. Выключение из кровообращения более У3 площади плаценты представляет опасность для жизни плода. Типичная клиническая картина острой ФПН наблюдается при преждевременной отслойке плаценты.
Клиническая картина хронической ФПН проявляется в нарушениях основных функций плаценты.
Об изменении дыхательной функции плаценты свидетельствуют в основном симптомы гипоксии плода. При этом вначале беременная обращает внимание на повышенную (беспорядочную) двигательную активность плода, затем на ее уменьшение или полное отсутствие.
Наиболее характерный признак хронической ФПН заключается в задержке внутриутробного развития (ЗВУР) плода. Клинически ЗВУР плода проявляется уменьшением размеров живота беременной (окружность живота, высота стояния дна матки) по сравнению с нормативными показателями, характерными для данного срока беременности. Различают две формы ЗВУР: симметричную и асимметричную в зависимости от этиологии, времени возникновения и степени изменения состояния плода.
При симметричной форме, которая развивается с ранних сроков беременности, отмечается пропорциональное отставание длины и массы тела плода. При этом количественные показатели фетометрии имеют более низкие значения по сравнению с индивидуальными колебаниями, характерными для данного срока беременности.
Причинами этой формы ЗВУР чаше всего являются хромосомные аномалии, внутриутробные инфекции, недостаточное питание матери, длительное воздействие вредных факторов. Наиболее тяжелые формы ФПН, как правило, сопровождаются именно симметричной формой ЗВУР.
Асимметричная форма характеризуется непропорциональным развитием плода. Эта форма чаще всего возникает во II или в III триместре беременности и проявляется отставанием массы тела плода при нормальной его длине. Преимущественно уменьшаются размеры живота и грудной клетки плода, что связано с отставанием развития паренхиматозных органов (в первую очередь печени) и подкожной жировой клетчатки. Размеры головы и конечностей плода соответствуют показателям, характерным для данного срока беременности.
При хронической ФПН на фоне различной патологии могут отмечаться оба типа ЗВУР, однако более часто встречается асимметричная форма.
Отражением нарушений защитной функции плаценты при ослаблении плацентарного барьера является внутриутробное инфицирование плода под действием проникающих через плаценту патогенных микроорганизмов. Возможно также проникновение через плацентарный барьер различных токсичных веществ, также оказывающих повреждающее действие на плод.
Изменение синтетической функции плаценты сопровождается дисбалансом уровня вырабатываемых ею гормонов и снижением синтеза белков, что проявляется ЗВУР плода, гипоксией, патологией сократительной активности матки при беременности и в родах (длительная угроза преждевременного прерывания беременности, преждевременные роды, аномалии родовой деятельности).
Длительное и частое повышение тонуса миометрия приводит к снижению артериального притока крови к плаценте и вызывает венозный застой.
Гемодинамические нарушения снижают газообмен между организмом матери и плода, что затрудняет поступление к плоду кислорода, питательных веществ, выведение продуктов метаболизма, способствует нарастанию гипоксии плода.
Нарушение эндокринной функции плаценты может приводить и к перенашиванию беременности.
Снижение гормональной активности плаценты вызывает расстройство функции влагалищного эпителия, создавая благоприятные условия для развития инфекции, обострения или возникновения воспалительных заболеваний мочеполовой системы.
На фоне расстройства выделительной функции плаценты и околоплодных оболочек отмечается патологическое количество околоплодных вод — чаще всего маловодие, а при некоторых патологических состояниях (сахарный диабет, отечная форма гемолитической болезни плода, внутриутробное инфицирование и др.) — многоводие.
Таким образом, наиболее типичными клиническими проявлениями хронической ФПН являются:
- гипоксия плода;
- задержка внутриутробного развития плода;
- угроза преждевременного прерывания беременности;
- перенашивание беременности;
- многоводие или маловодие.
На начальном этапе развития ФПН перечисленные клинические признаки могут быть выражены слабо или отсутствовать. В этой связи существенное значение приобретают методы лабораторного и инструментального динамического контроля за состоянием фетоплацентарного комплекса в группе высокого риска по развитию ФПН.
Доминирующее положение в клинической картине могут занимать признаки основного заболевания или осложнения, при котором развилась ФПН. Степень выраженности ФПН и нарушения компенсаторно-приспособительных механизмов находится в прямой зависимости от тяжести основного заболевания и длительности его течения. Наиболее тяжелое течение ФПН приобретает при появлении патологических признаков в срок беременности до 30 нед и ранее.
Таким образом, наиболее полную информацию о форме, характере, степени тяжести ФПН и выраженности компенсаторно-приспособительных реакций позволяют получить данные, полученные при комплексной динамической диагностике.
Диагностика и ведение беременных с фетоплацентарной недостаточностью
С учетом многофакторной этиологии и патогенеза ФПН ее диагностика должна быть основана на комплексном обследовании пациентки. Диагностика ФПН включает:
- данные анамнеза;
- клиническое исследование;
- эхографическую фетометрию;
- плацентографию;
- эхографическую функциональную оценку состояния фетоплацентарной системы;
- допплерографию МПК и ФПК;
- кардиотокографию;
- кардиоинтервалографию;
- в качестве дополнительных исследований может быть проведено определение уровня гормонов и специфических белков беременности.
Для установления диагноза ФПН и выявления причин этого осложнения значительное внимание следует уделять правильному сбору анамнеза. При опросе оценивают возраст пациентки (поздний или юный возраст первородящей женщины), особенности ее здоровья, перенесенные экстрагенитальные, нейроэндокринные и гинекологические заболевания, хирургические вмешательства, наличие вредных привычек, выясняют профессию, условия и образ жизни.
Большое значение имеет информация об особенностях менструальной функции, периоде ее становления, количестве и течении предшествующих беременностей. Нарушения менструальной функции являются отражением патологии нейроэндокринной регуляции репродуктивной функции.
Важно оценить течение настоящей беременности, характер акушерских осложнений и, главное, наличие заболеваний, на фоне которых развивается данная беременность (артериальная гипертензия или гипотония; патология почек, печени, сахарный диабет, анемия и др.).
Следует обратить внимание на жалобы беременной: увеличение или угнетение двигательной активности плода, боли внизу живота, повышение тонуса матки, появление нетипичных выделений из половых путей, которые могут сопровождаться неприятным запахом и зудом.
При объективном исследовании пальпаторно оценивают состояние тонуса матки. Измеряют высоту стояния дна матки и окружность живота, сопоставляя их с массой тела и ростом беременной, а также уточненным сроком беременности. Такие измерения являются важными и в то же время наиболее простыми показателями для диагностики ЗВУР плода, маловодия и многоводия.
Измерение ВСДМ и длины окружности живота можно применять в качестве скринингового метода диагностики. Наиболее точно диагноз ЗВУР плода при помощи измерений устанавливают после 32 нед беременности. Возможно выявление отставания в развитии плода и во II триместре при ФПН. Отставание ВСДМ на 2 см и более по сравнению со стандартными показателями или отсутствие ее увеличения в течение 2— 3 нед дает основание предполагать наличие ЗВУР.
При наружном осмотре половых органов и при исследовании с помощью зеркал необходимо обратить внимание на наличие признаков воспаления, характер выделений из половых путей, взять материал со стенки влагалища, из шеечного канала и мочеиспускательного канала для микробиологического и цитологического исследования.
При эхографическом исследовании определяют размеры плода (размеры головы, туловища и конечностей) и сопоставляют их с нормативными показателями, характерными для предполагаемого гестационного срока.
Основой ультразвуковой диагностики для уточнения срока беременности и обнаружения ЗВУР плода служит сопоставление фетометрических показателей с нормативными для данного срока беременности.
Непременным условием является оценка анатомических структур плода для обнаружения аномалий его развития.
Эхографическое исследование включает в себя и плацентографию. При этом определяют локализацию плаценты, толщину ее, расстояние плаценты от внутреннего зева, соответствие степени зрелости плаценты гестационному сроку, патологические включения в структуре плаценты, расположение плаценты по отношению к миоматозным узлам или рубцу на матке.
В качестве показателя функционального состояния фетоплацентарного комплекса целесообразно определять сердечную деятельность плода при помощи эхографического исследования для выявления частоты его сердцебиений и характера сердечного ритма.
Дыхательные движения плода оценивают по их частоте, продолжительности эпизодов и по форме.
Двигательную активность плода характеризуют на основании определения количества ее эпизодов и характера движений туловищем и конечностями. Кроме регистрации этих показателей, необходимо учитывать такое явление, как беспорядочная повышенная двигательная активность плода, которая является одним из важных признаков нарушения его состояния.
Тонус плода расценивают как его способность при физологическом состоянии в процессе движения разгибать конечности и/или позвоночник с последующим полным возвращением в исходное положение сгибания.
В оценку функционального состояния фетоплацентарной системы включаются данные фетометрии, о структуре плаценты и об объеме околоплодных вод.
Допплерография представляет собой высокоинформативный, относительно простой и безопасный метод диагностики, который можно использовать для комплексного динамического наблюдения за состоянием кровообращения в системе мать — плацента — плод после 18—19 нед беременности, так как к этому времени завершается вторая волна инвазии цитотрофобласта.
Характер гемодинамики в артериях пуповины позволяет судить о состоянии фетоплацентарного кровотока (ФПК) и о микроциркуляции в плодовой части плаценты.
Изменения кровотока, определяемые в грудном отделе нисходящей аорты плода, отражают состояние компенсаторно-приспособительных механизмов его центральной гемодинамики при патологии беременности.
Для диагностики нарушения маточно-плацентарного кровотока (МПК) проводят исследования в маточных артериях с двух сторон.
Важной составной частью комплексной оценки состояния плода является кардиотокография (КТГ), которая представляет собой метод функциональной оценки состояния плода на основании регистрации частоты его сердцебиений и их изменений в зависимости от сокращений матки, действия внешних раздражителей или активности самого плода. КТГ значительно расширяет возможности антенатальной диагностики, позволяя решать вопросы рациональной тактики ведения беременности.
Оценка вариабельности сердечного ритма с помощью кардиоинтервалографии (КИГ) позволяет выяснить степень активности различных звеньев регуляторных механизмов и составить представление о выраженности общей приспособительной реакции организма плода на определенное стрессорное воздействие. Результатом математического анализа полученных данных является оценка уровня адаптационно-компенсаторных возможностей плода.
Для рационального ведения беременных с ФПН целесообразно использовать определенный алгоритм исходя из степени выраженности осложнения, подтвержденной результатами комплексной диагностики.
▲ Если при обследовании беременных группы высокого риска по развитию ФПН, по данным клинической и эхографической диагностики, а также по результатам допплерографии, КТГ и КИГ не обнаружено диагностических признаков данного осложнения, то дальнейшее ведение этих пациенток целесообразно осуществлять следующим образом. Рекомендуется повторное эхографическое исследование с функциональной оценкой состояния фетоплацентарного комплекса (без фетометрии) и допплерография через 7 дней. Повторную КТГ и КИГ выполняют не позднее чем через 5 дней. Проведение указанных диагностических мероприятий и сроки их проведения обусловлены необходимостью своевременно выявить начало проявления ФПН. При необходимости проводят лечение в зависимости от наличия и характера акушерской патологии, сопутствующих заболеваний и результатов обследования.
▲ При наличии компенсированной формы ФПН, которая характеризуется соответствующими клиническими данными, результатами эхографической диагностики, а также возможным изолированным нарушением МПК или ФПК (допплерография), начальным нарушением реактивности сердечно-сосудистой системы (КТГ), средним уровнем адаптационно-компенсаторных возможностей организма плода (КИГ), алгоритм ведения беременных заключается в следующем. Беременную следует госпитализировать в стационар. В ряде случаев возможно амбулаторное ведение беременных при условии, что начатое лечение оказывает должный эффект и имеются необходимые условия для выполнения динамической комплексной диагностики. Повторное эхографическое исследование с функциональной оценкой состояния фетоплацентарного комплекса (без фетометрии) выполняют не позднее чем через 5 дней с учетом исходных нарушений. При нарушении только МПК или только ФПК в сочетании с нормальными показателями КТГ и КИГ допплерографию проводят не позднее чем через 5 дней. При сочетании нарушений реактивности сердечно-сосудистой системы плода, показателей КИГ и гемодинамики допплерография, КТГ и КИГ проводят через день. Лечение осуществляют в зависимости от состояния беременной, выявленной акушерской патологии, сопутствующих заболеваний и результатов обследования. Проводимые лечебно-диагностические мероприятия направлены на предотвращение нарастания тяжести ФПН и своевременное выявление перехода компенсированной ФПН в более тяжелые формы.
▲ Выявление субкомпенсированной формы ФПН, что подтверждается результатами клинической диагностики, наличием соответствующих эхографических признаков, изолированным или сочетанным нарушением МПК и ФПК, умеренным нарушением реактивности сердечно-сосудистой системы плода (КТГ) и снижением уровня адаптационно-компенсаторных возможностей плода (КИГ), требует проведения следующих мероприятий. Беременную необходимо срочно госпитализировать в стационар. Динамический эхографический контроль с функциональной оценкой состояния фетоплацентарного комплекса (без фетометрии) осуществляют каждые 3—4 дня. При нарушении только МПК или только ФПК допплерографию проводят через день, а при сочетанном нарушении гемодинамики — ежедневно, так же как КТГ и КИГ. Проводят соответствующее лечение субкомпенсированной формы ФПН. Решают вопрос о сроках и способе родоразрешения.
▲ Если имеют место соответствующие клинические и эхографические признаки декомпенсированной формы ФПН и сопутствующие им нарушения МПК и ФПК, включая критические, а также выраженные нарушения реактивности сердечно-сосудистой системы плода (КТГ) и низкий уровень адаптационно-компенсаторных возможностей плода, следует осуществлять следующие мероприятия. После немедленной госпитализации в стационар необходимо решать вопрос об экстренном родоразрешении путем кесарева сечения. В рамках подготовки к родоразрешению осуществляют мониторный контроль за состоянием плода (КТГ и КИГ) и оказывают ему экстренную помощь путем внутривенного капельного введения пациентке соответствующих лекарственных средств.
При выявлении признаков компенсированной формы ФПН возможно амбулаторное ведение беременных в том случае, если проводимое лечение эффективно и имеются необходимые условия для выполнения динамической комплексной диагностики.
Если на момент первичной диагностики срок беременности составляет менее 32 нед, диагностика ограничивается эхографическим исследованием и допплерографией. В более поздний срок комплексное обследование следует дополнить КТГ и КИГ. При нарастании тяжести ФПН интервалы между исследованиями сокращаются и увеличивается спектр используемых методик.
Особого внимания заслуживает тактика ведения беременных с ФПН, которая сопровождается гипоксией, ЗВУР плода и гемодинамическими нарушениями (включая критические показатели ФПК), в сроки беременности менее 34 нед. В этой ситуации целесообразно пролонгирование беременности с проведением соответствующей терапии. Такая тактика оправдана тем, что для перинатальных исходов является крайне неблагоприятным сочетание ЗВУР плода и его недоношенности. Следует учитывать, что до 34 нед беременности нарушения МПК и ФПК могут иметь функциональный характер. Положительный эффект терапии при сроке беременности менее 34 нед при выраженных нарушениях гемодинамики может быть получен до 94 % наблюдений, что позволяет пролонгировать беременность до 36—37 нед и более.
При попытке пролонгирования беременности, сопровождающейся выраженной ФПН ранее 34 нед, отсутствие эффекта от проводимой терапии и ухудшение результатов динамического контроля являются поводом для изменения тактики ведения в пользу досрочного родоразрешения.
Представленный алгоритм служит общей схемой мероприятий ведения беременных с различными формами ФПН.
Окончательная тактика ведения пациентки должна быть выработана не только на основе оценки отдельных показателей состояния фетоплацентарного комплекса, но и с учетом индивидуальных особенностей конкретного клинического наблюдения (срок и осложнения беременности, сопутствующая соматическая патология, результаты дополнительного комплексного обследования, состояние и готовность организма к родам и т. д.).
Фетоплацентарная недостаточность. Лечение
При выявлении ФПН беременную необходимо сразу госпитализировать в стационар для углубленного обследования и лечения. Исключение могут составлять беременные с компенсированной формой ФПН при условии, что начатое лечение дает положительный эффект и имеются необходимые условия для динамического клинического и инструментального контроля за характером течения беременности и эффективностью проводимой терапии.
Ведущее место в проведении лечебных мероприятий занимает лечение основного заболевания или осложнения, при которой возникла ФПН.
В настоящее время, к сожалению, не представляется возможным полностью избавить беременную от ФПН какими-либо лечебными воздействиями. Применяемые средства терапии могут способствовать только стабилизации имеющегося патологического процесса и поддержанию компенсаторно-приспособительных механизмов на уровне, позволяющем обеспечить продолжение беременности до возможного оптимального срока родоразрешения.
Учитывая многообразие факторов, приводящих к развитию ФПН, терапия этого осложнения должна носить комплексный характер и патогенетическую направленность.
Задачами лечения ФПН являются:
- оптимизация гомеостаза;
- поддержание компенсаторно-приспособительных механизмов в системе мать — плацента — плод, обеспечивающих возможность пролонгирования беременности;
- подготовка к родоразрешению в оптимальные сроки.
Лечение ФПН должно быть направлено на:
- улучшение МПК и ФПК;
- интенсификацию газообмена;
- коррекцию реологических и коагуляционных свойств крови;
- устранение гиповолемии и гипопротеинемии;
- нормализацию сосудистого тонуса и сократительной активности матки;
- усиление антиоксидантной защиты;
- оптимизацию метаболических и обменных процессов.
Стандартной схемы лечения ФПН существовать не может вследствие индивидуального сочетания этиологических факторов и патогенетических механизмов развития данного осложнения.
Подбор препаратов следует проводить индивидуально и дифференцированно в каждом конкретном наблюдении с учетом степени тяжести и длительности осложнения, этиологических факторов и патогенетических механизмов, лежащих в основе этой патологии. Индивидуального подхода требуют дозировка препаратов и продолжительность их применения. Следует обращать внимание на устранение побочного действия некоторых лекарственных средств.
Лечение ФПН начинают и проводят в стационаре не менее 4 нед с последующим ее продолжением в женской консультации. Общая длительность лечения составляет не менее 6—8 нед.
Для оценки эффективности проводимой терапии осуществляют динамический контроль с помощью клинических, лабораторных и инструментальных методов исследования.
Важным условием успешного лечения ФПН является соблюдение беременной соответствующего режима: полноценный отдых не менее 10— 12 ч в сутки, устранение физических и эмоциональных нагрузок, рациональное сбалансированное питание.
Одним из ведущих патогенетических механизмов развития ФПН являются нарушения МПК и ФПК, сопровождающиеся повышением вязкости крови, гиперагрегацией эритроцитов и тромбоцитов, расстройством микроциркуляции и сосудистого тонуса, недостаточностью артериального кровообращения. В связи с этим важное место в лечении ФПН занимают препараты антиагрегантного и антикоагулянтного действия, а также лекарственные средства, нормализующие сосудистый тонус.
Препараты антиагрегантного и антикоагулянтного действия улучшают кровоток, реологические и коагуляционные свойства крови, перфузию тканей, снабжение их кислородом и питательными веществами. Под влиянием ряда антиагрегантов ингибируется действие циклооксигеназы, снижается синтез тромбоксана, восстанавливается нарушенный баланс в продукции и содержании простагландинов с прессорной и депрессорной активностью.
Как показал многолетний клинический опыт, для улучшения МПК и ФПК наиболее эффективным является применение пентоксифиллина (трентал, агапурин). Препарат оказывает сосудорасширяющее действие, снижает периферическое сосудистое сопротивление, усиливает коллатеральное кровообращение и капиллярный кровоток, уменьшает спастическое сокращение прекапиллярных сфинктеров артериол. Снижая концентрацию фибриногена в плазме и усиливая фибринолиз, пентоксифиллин уменьшает вязкость крови и улучшает ее реологические свойства. Под действием пентоксифиллина повышается эластичность эритроцитов, восстанавливается способность к деформабельности и предотвращается агрегация. Препарат снижает продукцию тромбоксана и агрегацию тромбоцитов, повышает противоагрегационную активность эндотелия и продукцию простациклина. В результате действия пентоксифиллина улучшается транспортная и гормональная функция плаценты, повышается сопротивляемость плода к гипоксии.
В стационаре терапию тренталом осуществляют в виде внутривенного капельного введения 2—3 раза в неделю и проводят 4—6 вливаний. Для этого используют изотонический раствор хлорида натрия, 5 % раствор глюкозы и реополиглюкин. Трентал вводят в дозе 0,1 г 2 % раствора (5 мл) в 400 мл инфузионной среды в течение 1,5—3 ч. Введение начинают со скоростью 8—10 капель/мин и постепенно увеличивают ее до 20—25 капель/мин.
В связи со значительным сосудорасширяющим действием препарата возможно развитие симптома «обкрадывания» из-за уменьшения кровоснабжения ряда органов. Поэтому рекомендуется применять трентал через 30 мин после так называемой водной нагрузки (предварительного внутривенного введения 100—150 мл 5 % раствора глюкозы или изотонического раствора хлорида натрия).
Внутривенное введение трентала сочетают с приемом внутрь по 100 мг 3 раза или по 200 мг 2 раза в день после еды.
Агапурин в таблетках назначают в аналогичной дозе.
Реополиглюкин — низкомолекулярный декстран, молекулы которого обладают способностью прилипать к поверхности эндотелия сосудов, а также адсорбироваться на тромбоцитах и эритроцитах. Образующийся при этом мономолекулярный слой препятствует агрегации форменных элементов крови и адгезии их на сосудистой стенке. Под действием препарата снижается активация коагуляционного звена системы гемостаза, легче разрушаются кровяные сгустки, улучшаются реологические свойства крови.
Реополиглюкин способствует гемодилюции, устранению гиповолемии, возрастанию кровотока в плаценте, в головном мозге, миокарде, в почках, усиливает диурез, оказывает спазмолитическое действие на гладкую мускулатуру артериальных сосудов.
Не рекомендуется назначать реополиглюкин при выраженной гипопротеинемии, повышенной чувствительности к лекарственным препаратам, при бронхиальной астме, так как это может вызвать аллергические и коллаптоидные реакции.
Для улучшения процессов гемодинамики и микроциркуляции целесообразно применение дипиридамола (курантил).
Препарат, являясь активатором аденилатциклазы и ингибитором фосфодиэстеразы, увеличивает содержание цАМФ и аденозина в клетках гладкой мускулатуры сосудов, что приводит к их расслаблению и вазодилатации.
Под действием курантила повышение концентрации цАМФ в тромбоцитах предотвращает их агрегацию, адгезию, выделение активаторов агрегации, факторов свертывания крови и вазоконстрикторов.
За счет стимуляции синтеза простациклина в сосудистой стенке и снижения синтеза тромбоксана А2 в тромбоцитах курантил препятствует агрегации тромбоцитов и их адгезии к эндотелию сосудов.
Фибринолитическое действие препарата обусловлено высвобождением плазминогена из стенки сосудов.
Стимулируя аденозиновые рецепторы, курантил увеличивает плотность капиллярного русла, активизирует коллатеральное кровообращение, компенсируя снижение МПК.
Принимая во внимание, что одним из ключевых патогенетических механизмов развития ФПН является нарушение кровообращения в системе мать — плацента — плод, терапевтическое действие курантила направлено на улучшение микроциркуляции, торможение тромбообразования, уменьшение общего периферического сосудистого сопротивления, расширение сосудов, улучшение доставки кислорода к тканям, предотвращение гипоксии плода.
Благодаря применению курантила улучшается МПК и ФПК (повышается артериальный приток и нормализуется венозный отток из межворсинчатого пространства), снижается или устраняется гипоксия плода, редуцируются морфофункциональные нарушения в плаценте.
Положительный терапевтический эффект курантила выражается также в улучшении церебрального, коронарного и почечного кровотока, увеличении сердечного выброса, некотором снижении артериального давления.
Являясь стимулятором выработки эндогенного интерферона, курантил способствует антивирусной защите организма беременной.
Курантил не повышает тонус матки и не обладает эмбриотоксическим действием.
Препарат назначают внутрь в дозе 25 мг за 1 ч до еды 2—3 раза в день. Курс терапии — 4—6 нед.
Для устранения нарушений микроциркуляции при ФПН рекомендуется назначение малых доз аспирина по 60—80 мг/сут за один прием. Курс терапии составляет не менее 3—4 нед или продолжается до 37 нед беременности.
Аспирин в малых дозах снижает продукцию тромбоксанов, избирательно подавляя тромбоцитарную циклооксигеназу, устраняя тем самым дисбаланс между синтезом и содержанием простациклинов и тромбоксанов. Кроме того, препарат снижает чувствительность сосудов к ангиотензину II.
При нарушениях коагуляционных свойств крови, вызванных одновременной активацией плазменного и тромбоцитарного звеньев гемостаза (выраженные признаки гиперкоагуляции), целесообразно назначение препаратов гепарина, учитывая их способность блокировать локальный тромбоз и предотвращать генерализацию процесса во всей системе микро- и макроциркуляции.
Факторами риска развития тромбофилических состояний при ФПН являются: нарушение жирового обмена, гипертоническая болезнь, заболевания сердца, сахарный диабет, заболевания почек, дефекты гемостаза, тромбоз глубоких вен в анамнезе, длительный прием оральных контрацептивов до беременности, гестоз, многоплодная беременность, антифосфолипидный синдром.
Гепарин обладает как антитромбиновым, так и антитромбопластиновым действием, которое обусловлено взаимодействием комплекса гепарин — антитромбин III с тромбином и рядом факторов свертывания (Ха, XII, XIa, IXa).
В результате ингибирования тромбопластина гепарин снижает отложение фибрина в плаценте и улучшает микроциркуляцию.
Препарат обладает антигипоксическим действием, повышает адаптационную способность тканей, нормализует проницаемость сосудистой стенки, участвует в процессах регуляции тканевого гомеостаза и ферментных процессах. Гепарин не проникает через плацентарный барьер и не оказывает повреждающего действия на плод.
Гепарин назначают в малых дозах по 500— 1000 ЕД под кожу живота (с целью пролонгированного эффекта) 4 раза в сутки в течение 3— 5 дней (суточная доза 2000—4000 ЕД) в сочетании с двукратной инфузией реополиглюкина по 200 мл (2 раза в неделю).
Учитывая, что гепарин является катализатором антитромбина III и при низком его содержании неэффективен, препарат применяют только в сочетании с внутривенным введением 200 мл свежезамороженной плазмы (3—5 вливаний на курс лечения). Преимущество малых доз гепарина заключается в поддержании его уровня в крови в пределах 0,2 ЕД/мл. Эта концентрация является оптимальной для активации антитромбина III и не вызывает геморрагических осложнений.
В процессе терапии гепарином проводят гемостазиологический контроль не реже 2 раз в неделю.
Препарат отменяют после 37 нед беременности и не позднее чем за 2—3 сут перед досрочным родоразрешением.
К противопоказаниям использования гепарина относятся: гипокоагуляция, болезни крови, любое кровотечение, предлежание плаценты, геморрагический диатез, язвенная болезнь любой локализации, наличие опухолей. Гепарин не следует применять при тяжелой артериальной гипертензии из-за опасности развития геморрагического инсульта в головной мозг и образования подкапсульной гематомы печени.
Обладая гетерогенной структурой, гепарин имеет биодоступность только 30 %, так как связывается с белками клеток. Кроме того, гепарин подвергается влиянию антигепаринового фактора тромбоцитов, что может привести к развитию гепариновой иммунной тромбоцитопении. К отрицательным эффектам гепарина относят также возможность развития гиперкоагуляции и тромбоза в результате истощения антитромбина III при передозировке препарата.
В последние годы в акушерской практике используют низкомолекулярные гепарины (НМГ), обладающие более выраженной противотромботической активностью и меньшими побочными эффектами.
НМГ имеют более высокую биодоступность (до 98 %) по сравнению с гепарином, больший период полужизни, меньше связываются с различными белками и клетками и способны к длительной циркуляции в плазме. НМГ не обладают антитромбиновым свойством и не вызывают гипокоагуляции. Кроме того, НМГ не приводят к иммунным тромбозам, так как мало подвержены влиянию антигепаринового фактора 4 тромбоцитов.
НМГ препятствуют образованию тромбина не только через антитромбин III, но и через ингибитор внешнего пути свертывания TFPJ наряду с другими фармакологическими эффектами. Это особенно важно в связи с тем, что тромботические явления при акушерских осложнениях чаще всего обусловлены активацией внешнего пути свертывания.
Следует подчеркнуть, что каждый из НМГ представляет собой отдельный препарат с соответствующими и свойственными только ему характеристиками и дозировками.
Одним из препаратов группы НМГ является фраксипарин, который вводят в подкожную жировую клетчатку передней брюшной стенки в дозе 0,3 мл (2850 ME) 1—2 раза в день.
Возможно также применение фрагмина путем подкожного введения по 2500 ME ежедневно 1 раз в день. Противосвертывающий эффект препарата обусловлен в первую очередь ингибированием фактора Ха, а также его влиянием на сосудистую стенку или фибринолитическую систему.
Длительность терапии НМГ зависит от характера основного заболевания.
Результаты исследований по применению НМГ в акушерской практике с целью предупреждения тромбозов, невынашивания беременности и ФПН показали, что препараты этой группы высокоэффективны в профилактике и лечении этих осложнений, они не приводят к увеличению кровопотери во время родов, позволяют проводить профилактику и терапию длительное время.
Для лабораторного мониторинга применения НМГ целесообразно использовать тесты по определению анти-Ха-активности.
Некоторые осложнения беременности и экстрагенитальные заболевания, приводящие к развитию ФПН, сопровождаются выраженной гиповолемией, усугубляющей состояние фетоплацентарной системы.
Для устранения гиповолемии при ФПН можно применять коллоидный плазмозамещающий раствор на основе гидроксиэтилированного крахмала — инфукол ГЭК 10 %. Препарат является гиперонкотическим раствором, который, удерживая воду в сосудистом русле, способствует устранению гиповолемических состояний при низком осмотическом давлении (менее 20 мм рт. ст.), обеспечивает возмещение объема циркулирующей жидкости и гемодилюцию.
При использовании раствора гидроксиэтилированного крахмала снижаются показатели гематокритного числа и агрегации эритроцитов. Уменьшается вязкость крови и плазмы. Ослабляется тромбообразование без нарушения функции тромбоцитов. Восстанавливается микроциркуляция и возрастает доставка кислорода к тканям.
Инфукол ГЭК 10 % применяют во II и III триместрах беременности при гематокритном числе более 35 %. Препарат вводят через день внутривенно капельно по 250 мл в течение 2—3 ч. Курс терапии — 3—5 вливаний.
При выраженной гипопротеинемии у беременных с ФПН необходимо применение свежезамороженной плазмы в количестве 100—200 мл путем внутривенного капельного введения 2—3 раза в неделю.
При выполнении инфузионной терапии необходимо первоначально выяснить переносимость препарата, реакцию организма на введение его небольшого количества, контролировать показатели артериального давления, частоту пульса и дыхания, диурез, оценивать субъективное и объективное состояние пациентки.
Коррекция МПК и ФПК сосудорасширяющими средствами в сочетании с нормализацией реологических и коагуляционных свойств крови способствует улучшению транспорта питательных веществ и газообмена между организмом матери и плода, а также является важным фактором в синтезе гормонов. Направлениями терапии для улучшения гемодинамики являются улучшение гемодинамики в системе маточно-плацентарного и фетоплацентарного звеньев кровообращения, нормализация тонуса матки.
Для коррекции гемодинамических нарушений при ФПН назначают антагонисты ионов кальция (верапамил, коринфар), которые снижают периферическое сосудистое сопротивление и диастолическое артериальное давление, улучшают перфузию жизненно важных органов, нормализуют сократительную деятельность миокарда, обладают гипотензивным действием, расширяют сосуды почек. Преимущества антагонистов ионов кальция заключаются в том, что при их применении не уменьшается сердечный выброс, происходит постепенное снижение артериального давления пропорционально дозе препарата (без явлений ортостатической гипотонии).
Монотерапия антагонистами ионов кальция имеет преимущества перед комбинированной гипотензивной терапией в связи с меньшим проявлением побочных эффектов, связанных с взаимодействием нескольких лекарственных средств. Кроме того, эти препараты обладают блокирующим свойством при агрегации тромбоцитов и эритроцитов.
Коринфар назначают внутрь по 10 мг 2 раза в день в течение 2—3 нед. Верапамил — по 80 мг 2 раза в день в течение 2—3 нед.
В качестве сосудорасширяющего средства применяют эуфиллин, который вводят в виде 2,4 % раствора по 5 мл внутривенно капельно в 250 мл 5 % раствора глюкозы или струйно медленно в 20—40 мл 20 % раствора глюкозы. При этом внутривенное капельное введение применяют при артериальной гипертензии, но не при нормальном или сниженном артериальном давлении.
Эффективное спазмолитическое действие оказывает но-шпа. Препарат назначают внутрь по 0,04 г (1 таблетка) 2—3 раза в день, а также вводят внутримышечно или внутривенно по 2 мл 2 % раствора. Продолжительность курса терапии 2—3 нед.
Снижению тонуса и резистентности сосудистой стенки способствует применение магне В6. Ионы магния при использовании препарата уменьшают возбудимость нейронов и замедляют нервно-мышечную передачу, а также участвуют в различных метаболических процессах наряду с пиридоксином. Магне В6 назначают по 2 таблетки 2—3 раза в день.
Не утратила своего терапевтического значения глюкозоновокаиновая смесь (10 % раствор глюкозы 200 мл и 0,25 % раствор новокаина 200 мл). Внутривенно данную смесь вводят 2—3 раза в неделю (3—5 вливаний).
Основной механизм действия смеси заключается в способности новокаина «выключать» сосудистые рецепторные поля и уменьшать сосудистый спазм, что улучшает микроциркуляцию и кровоток в системе артериальных сосудов плаценты и почек.
Наиболее целесообразно глюкозоновокаиновую смесь сочетать с тренталом. Следует принимать во внимание, что периодическое и длительное повышение тонуса матки способствует нарушению кровообращения в межворсинчатом пространстве вследствие снижения венозного оттока.
В этой связи в курсе терапии ФПН у пациенток с явлениями угрозы прерывания беременности оправданно назначение препаратов токолитического действия (β-адреномиметики), к которым, в частности, относят партусистен и гинипрал. Эти препараты способствуют расслаблению маточной мускулатуры (воздействуя на β-адренорецепторы), расширению сосудов, снижению их резистентности, что обеспечивает усиление МПК. Однако на фоне применения препаратов возможны перераспределение крови в организме беременной и уменьшение оксигенации плода. В связи с этим β-адреномиметики рекомендуется сочетать с кардиотоническими средствами и проводить жидкостную нагрузку. Действие β-адреномиметиков зависит как от дозы, так и от способа введения и их фармакодинамики. Для достижения быстрого эффекта β-адреномиметики следует вводить внутривенно. Прием их внутрь обеспечивает хорошее всасывание, но более медленное действие.
Партусистен в дозе 0,5 мг разводят в 250 мл 5 % раствора глюкозы. В 1 мл (20 каплях) этого раствора содержится 50 мкг препарата. Партусистен вводят внутривенно капельно со скоростью 15— 20 капель/мин в течение 3—4 ч. За 15—20 мин до окончания введения партусистен дают внутрь в дозе 5 мг 4 раза в сутки. Далее курс терапии можно продолжить путем назначения препарата внутрь с индивидуальном подбором наиболее эффективной дозы. Продолжительность курса терапии до 1—2 нед. Длительно препарат применять не следует из-за опасности кардиотропного влияния на плод.
Гинипрал также вводят внутривенно капельно в дозе 0,025 мг (5 мл) в 400 мл 5 % раствора глюкозы или изотонического раствора хлорида натрия. Внутрь препарат назначают по 0,5 мг/сут.
Следует соблюдать определенную осторожность при одновременном использовании препаратов, обладающих гипотензивным действием. Выраженное снижение артериального давления приводит к уменьшению маточно-плацентарной перфузии и ухудшению состояния плода, особенно на фоне хронической гипоксии.
Прогрессирование гипоксии происходит на фоне интенсификации ПОЛ, образованию и накоплению продуктов пероксидации, повреждающих митохондриальные и клеточные мембраны. Активация этого процесса обусловлена ослаблением механизмов антиоксидантной защиты.
Важное значение в терапии ФПН имеет нормализация антиоксидантной защиты, что оказывает положительное влияние на транспортную функцию плаценты.
Витамин Е (токоферола ацетат) — природный антиоксидант, который тормозит процессы перекисного окисления липидов, принимает участие в синтезе белков, тканевом дыхании, способствует нормализации функции клеточных мембран. Препарат назначают внутрь 1 раз в день по 200 мг в течение 10—14 дней.
Аскорбиновая кислота (витамин С), являясь важным компонентом антиоксидантной системы, участвует в регуляции окислительно-восстановительных реакций, углеводного обмена, способствует регенерации тканей, образованию стероидных гормонов, оказывает существенное влияние на нормализацию проницаемости сосудистой стенки, улучшает дыхательную и метаболическую функцию плаценты. Аскорбиновую кислоту назначают внутрь по 0,1—0,3 г 2 раза в день, или внутривенно с глюкозой по 3 мл в течение 10—14 дней.
Учитывая важнейшую детоксикационную функцию печени, а также ее определяющую роль в продукции белков и прокоагулянтов, в комплексной терапии ФПН целесообразно использовать гепатопротекторы, среди которых следует выделить эссенциале.
Препарат улучшает течение ферментативных реакций, функцию печени, микроциркуляцию. Под его влиянием в плаценте нормализуются процессы липидного обмена, биосинтеза циклических нуклеотидов, белков и других веществ. Препарат способствует стабилизации клеточных мембран, улучшает метаболизм и регенерацию гепатоцитов.
Эссенциале (5 мл) вводят с 5 % раствором глюкозы (200 мл) внутривенно капельно. Эссенциале форте назначают внутрь по 2 капсулы 3 раза в день во время еды в течение 4 нед.
Гепатозащитное действие оказывает и легален (силимарин), стимулирующий синтез рибосомной РНК, которая является основным источником синтеза белка. Легалон назначают по 35 мг 3 раза в день. Курс терапии — 3 нед.
Неотъемлемой частью комплекса терапевтических мероприятий является применение лекарственных средств, направленных на улучшение метаболических и биоэнергетических процессов, что также способствует улучшению гемодинамики, газообмена и других функций плаценты.
Витамин В6 (пиридоксина гидрохлорид) активно участвует в синтезе и обмене аминокислот, в процессах жирового обмена, оказывает положительное влияние на функцию центральной
и периферической нервной системы. Препарат вводят внутримышечно по 1—2 мл 5 % раствора через день в течение 10—12 дней.
Кокарбоксилаза улучшает регуляцию углеводного обмена, способствует сохранению гликогена в печени, активизирует аэробные процессы обмена. Кокарбоксилазу целесообразно вводить внутривенно в количестве 0,1 г в сочетании с раствором глюкозы в течение 2 нед.
В комплекс терапевтических мероприятий целесообразно включать фолиевую кислоту, которая принимает участие в образовании гема, стимулируют обменные процессы, участвует в синтезе аминокислот и нуклеиновых кислот, оказывает благоприятное влияние на метаболическую функцию плаценты и состояние плода.
Недостаток фолиевой кислоты отрицательно влияет на эритропоэз, может привести к развитию артериальной гипертензии и отслойке плаценты.
Фолиевую кислоту назначают внутрь по 400 мкг в день в течение 3—4 нед.
Незаменимые аминокислоты, к которым относят метионин и глутаминовую кислоту, принимают участие в метаболизме плаценты, способствуют улучшению окислительно-восстановительных процессов и транспорта кислорода.
Глутаминовую кислоту принимают внутрь по 0,5—1,0 г 3 раза в день. Метионин назначают внутрь по 0,5 г 3 раза в день повторными курсами в течение 3—4 нед.
Для уменьшения гипоксии целесообразно назначать цитохром С, который является катализатором клеточного дыхания, стимулирует окислительные реакции и обменные процессы. Препарат вводят внутривенно по 15 мг 1—2 раза в день. Курс 3 нед.
В комплексе метаболической терапии рекомендуется также использование комбинированных поливитаминных препаратов, содержащих макро- и микроэлементы (пренатал, прегнавит и др.).
В развитии ФПН важное место занимает недостаточность энергетического обеспечения тканевого метаболизма, что обусловлено нарушением обмена углеводов и липидов.
Для поддержания метаболической функции плаценты при ФПН важным компонентом терапии является глюкоза.
Энергетические потребности плода обеспечиваются за счет запасов гликогена, которые снижаются при гипоксии вследствие активации анаэробного гликолиза. На этапе компенсаторной активации метаболических процессов целесообразно введение глюкозы для поддержания энергетических ресурсов плода.
Глюкоза легко проникает через плаценту, улучшает газообмен плода путем повышения к нему транспорта кислорода и выведения угольной кислоты (углекислоты), увеличивает содержание гликогена. При беременности толерантность к глюкозе снижается и ее применение требует контроля за содержанием глюкозы в крови.
При лечении ФПН наиболее эффективным является внутривенная инфузия глюкозы в сочетании с адекватным количеством инсулина, который способствует утилизации глюкозы тканями, включает ее в энергетический цикл и улучшает внутриклеточный обмен.
Глюкозу вводят внутривенно в виде 5—10 % раствора в количестве 200—250 мл вместе с инсулином (из расчета 1 ЕД на 4 г сухого вещества), кокарбоксилазой, аскорбиновой кислотой, витамином В6 в течение 10 дней в условиях стационара.
Одной из причин снижения функции клеточных мембран при истощении компенсаторных возможностей фетоплацентарной системы является нарушение пентозофосфатного пути окисления глюкозы.
Вследствие выраженного нарушения углеводного обмена применение глюкозы с энергетической целью при декомпенсированной форме ФПН нецелесообразно.
Введение глюкозы при выраженной гипоксии плода приводит к значительному накоплению продуктов ПОЛ в его организме, развитию ацидоза и снижению утилизации кислорода тканями. Наличие гипергликемии у новорожденных, перенесших тяжелую гипоксию во время беременности, также свидетельствует в пользу ограничения введения глюкозы при явлениях декомпенсации.
В рамках метаболической терапии при ФПН заслуживает внимания применение актовегина, который представляет собой высокоочищенный депротеинизированный гемодериват из телячьей крови, содержащий низкомолекулярные пептиды и дериваты нуклеиновых кислот.
Не содержит компонентов, обладающих антигенными или пирогенными свойствами.
Под действием актовегина в условиях гипоксии и недостаточности периферического кровообращения происходит следующее.
На клеточном уровне:
- увеличение доставки кислорода и глюкозы в ткани, накопление их в клетках;
- стимуляция внутриклеточного аэробного метаболизма;
- усиление белоксинтезирующей функции клеток;
- возрастание энергетических ресурсов клеток;
- повышение толерантности клеток к гипоксии;
- уменьшение ишемического повреждения клеток.
На тканевом уровне:
- улучшение микроциркуляции и восстановление кровообращения в зоне ишемии за счет
повышения аэробного энергообмена, вазодилатации, усиления васкуляризации и развития коллатерального кровообращения;
- активация местного фибринолиза и уменьшение вязкости крови.
На системном и органном уровне:
- улучшаются показатели центральной гемодинамики у беременных и рожениц;
- возрастает минутный объем кровообращения;
- снижается общее периферическое сопротивление;
- оптимизируется МПК (за счет улучшения аэробного энергообмена сосудистых клеток, высвобождения простациклина и вазодилатации).
Актовегин не оказывает влияния на характер нормальной гемодинамики и показатели артериального давления.
Под влиянием актовегина улучшаются ФПК и внутриплацентарный кровоток; возрастает оксигенация крови, поступающей к плоду (за счет улучшения доставки кислорода и восстановления аэробного метаболизма в ткани плаценты); отмечается оптимизация темпов роста плода при ЗВУР (за счет увеличения ФПК, стимуляции процессов липолиза и белкового обмена); повышается устойчивость мозговой ткани к гипоксии (за счет активации метаболических процессов в головном мозге).
Применение актовегина при ФПН позволяет:
- пролонгировать беременность до оптимального срока родоразрешения;
- интенсифицировать МПК и ФПК;
- оптимизировать темп роста плода при ЗВУР;
- повысить переносимость плодом родового стресса (снижение риска развития острой гипоксии плода);
- улучшить адаптацию новорожденных в раннем неонатальном периоде.
С профилактической и лечебной целью назначают актовегин по 1 таблетке (200 мг 2—3 раза в день) с 16-й недели беременности.
Инфузионная терапия актовегином:
- разовая доза актовегина 160—200 мг;
- курс терапии 10 дней и более;
- инфузионная среда — 5 % раствор глюкозы или изотонический раствор хлорида натрия.
Терапевтический эффект актовегина начинает проявляться не позднее чем через 30 мин после введения препарата и достигает максимума в среднем через 3 ч.
У беременных с артериальной гипертензией при гестозе и ЗВУР плода оптимальный терапевтический эффект дает сочетание метаболического действия актовегина с гипотензивными препаратами (верапамил 2,5 мг) и лекарственными средствами, оказывающими антиагрегантное и вазоактивное действие (трентал, агапурин, курантил).
При ФПН, сопровождающейся угрозой прерывания беременности, актовегин может быть использован в сочетании с препаратами, снижающими тонус миометрия (гинипрал 0,125— 0,250 мг 2—6 раз в день; сульфат магния 25 % раствор — 10,0 мл), что предупреждает гипоксическое повреждение плода, оказывает положительное влияние на тонус матки, МПК и ФПК.
В качестве компонента метаболической терапии при ФПН с успехом может быть использован хофитол, представляющий собой лекарственный препарат растительного происхождения на основе сухого экстракта из листьев артишока полевого.
Хофитол обладает антиоксидантным и цито-протекторным действием, защищая клеточные мембраны от повреждающих факторов. Улучшает реологические свойства крови. Повышает клубочковую фильтрацию и восстанавливает выделительную функцию почек. Обладает гепатопротекторным действием. Улучшает детоксикационную функцию печени и восстанавливает ее белково-синтетическую функцию. Нормализует липидный, белковый, азотистый и углеводный обмен. Повышает кислородтранспортную функцию крови.
Под действием хофитола снижается артериальное давление, уменьшаются отеки и увеличивается диурез, улучшаются биохимические показатели, оптимизируется МПК и ФПК, улучшается состояние плода.
Препарат назначают по 5—10 мл в 200 мл изотонического раствора хлорида натрия внутривенно капельно. Проводят 5—10 инфузий через день с одновременным приемом 1—2 таблеток 3 раза в день в течение 3—4 нед.
Таким образом, при компенсированной форме ФПН назначают:
- антиагреганты (трентал, агапурин, курантил);
- инфузионную терапию (реополиглюкин с тренталом, глюкоза, глюкозоновокаиновая смесь);
- сосудорасширяющие препараты (коринфар, верапамил, но-шпа, эуфиллин, магне В6);
- препараты токолитического действия (партусистен, гинипрал) при угрозе прерывания беременности;
- антиоксиданты (витамин Е, аскорбиновая кислота);
- гепатопротекторы (эссенциале, легалон);
- препараты, активизирующие метаболические и биоэнергетические процессы (витамин В6, кокарбоксилаза, фолиевая кислота, глутаминовая кислота, метионин, цитохром С, комбинированные поливитаминные препараты).
При лечении субкомпенсированной формы
ФПН в первую очередь используют инфузионную терапию (реополиглюкин с тренталом, свежезамороженная плазма, инфукол ГЭК 10 %) наряду с другими вышеперечисленными группами препаратов.
Проведение медикаментозной терапии возможно только при компенсированной и субкомпенсированной форме. При декомпенсированной форме ФПН единственным выходом из создавшейся ситуации является экстренное родоразрешение.
В рамках подготовки к экстренному родоразрешению при декомпенсированной форме ФПН целесообразно применение инфузионной терапии.
Фетоплацентарная недостаточность. Особенности родоразрешения
Наличие неблагоприятных и усугубляющихся признаков ФПН, которые свидетельствуют о декомпенсации фетоплацентарного комплекса, сопровождающихся выраженной сочетанной редукцией МПК и ФПК, значительным нарушением реактивности сердечно-сосудистой системы плода и низким уровнем компенсаторно-приспособительных возможностей плода, служат показаниями для неотложного родоразрешения. В этой ситуации наиболее предпочтительно кесарево сечение.
Опасность родоразрешения через естественные родовые пути в данном случае заключается в том, что в процессе родовой деятельности существенно снижаются МПК и ФПК на фоне уже имеющегося расстройства кровообращения, что может вызвать интранатальную смерть плода (рис. 4).
При необходимости досрочного родоразрешения при беременности до 32 нед предпочтительным является крайне бережное кесарево сечение. Ребенок в эти сроки чаще всего располагается косо, поперечно или в тазовом предлежании. Особенно осторожно следует выводить головку плода (опасность кровоизлияния в мозг).
При досрочном родоразрешении и недоношенной беременности с целью профилактики респираторного дистресс-синдрома необходимо назначить глюкокортикостероиды. Следует подчеркнуть, что такая профилактика имеет смысл в сроки беременности 28—36 нед и может дать определенный эффект, если она продолжается не менее 2—3 дней.
Для проведения курса профилактической терапии применяют дексаметазон по 4 мг 2 раза в сутки внутримышечно 2—3 дня или в таблетках по 3 мг 4 раза в сутки в 1-й день, 2 мг 3 раза в сутки на 2-й день, 2 мг 2 раза в сутки на 3-й день, или дексазон по 4 мг внутримышечно 2 раза в сутки в течение 2 дней, либо преднизолон по 60 мг в сутки в течение 2 дней.
Если отсутствуют признаки декомпенсации фетоплацентарного комплекса, проводимая терапия эффективна и позволяет сложившая клиническая ситуация, то родоразрешение возможно через естественные родовые пути при соблюдении следующих условий:
- головное предлежание плода;
- полная соразмерность головки плода и таза матери;
- достаточная готовность организма к родам.
Для успешного начала и дальнейшего развития нормальной родовой деятельности одним из наиболее важных условий является наличие «зрелой» шейки матки.
Для подготовки организма к родам и последующей их индукции наиболее физиологически обосновано применение препаратов на основе простагландина Е2.
Наиболее эффективным препаратом для подготовки шейки матки к родам и последующего родовозбуждения путем эндоцервикального введения простагландина Е2 является гель препидил.
При достаточной готовности организма для индукции родов рекомендуется интравагинальное введение простина Е2 в виде геля.
При ведении родов у пациенток с ФПН в сочетании с артериальной гипертензией, гестозом или многоводием необходимо раннее вскрытие плодного пузыря при открытии маточного зева не менее чем на 4 см. Перед выполнением амниотомии внутривенно вводят 40 мл 40 % раствора глюкозы, 4 мл 2% раствора но-шпы, 100 мг кокарбоксилазы.
Ведение родов необходимо осуществлять с адекватным и поэтапным обезболиванием, особенно если в родах имеет место гипертензивный синдром.
Одним из эффективных методов обезболивания является эпидуральная анестезия, которую следует выполнять в активную фазу родов (раскрытие маточного зева на 4 см и более).
Положительными качествами эпидуральной анестезии являются симпатическая блокада, способствующая улучшению кровоснабжения матки и других жизненно важных органов и ее гипотензивный эффект. Этот вид анестезии не подавляет родовую деятельность.
Для обезболивания родов применяют комбинированную медикаментозную анестезию различными препаратами, обладающими анальгетическим, седативным и спазмолитическим свойствами.
Во время родов пациенткам с ФПН показана пункция вены (целесообразна катетеризация) для инфузионной корригирующей терапии, направленной на поддержание не только адекватного уровня МПК и ФПК, но и метаболических процессов в фетоплацентарном комплексе, а также на предотвращение аномалий сократительной деятельности матки.
С этой целью в активную фазу родов (период раскрытия маточного зева от 4 до 8—9 см) рекомендуется внутривенное введение спазмолитических препаратов, которые способствуют более эффективному раскрытию шейки матки в координации с продвижением головки плода, а также улучшают процессы микроциркуляции в миометрии и фетоплацентарном комплексе.
Для поддержания адекватного МПК, ФПК и оптимизации микроциркуляции в тканях при гестозе, гипертензионном синдроме, артериальной гипотонии целесообразно внутривенное введение 5,0 мл трентала с глюкозоновокаиновой смесью или с изотоническим раствором хлорида натрия, инфукола ГЭК 10 %, а также 5,0 мл 5 % аскорбиновой кислоты, кокарбоксилазы 150— 200 мг и 3,0 мл 1 % витамина В6.
В процессе ведения родов возможно развитие слабости родовой деятельности, что потребует применения утеротонических средств.
В наибольшей степени отрицательное воздействие на состояние плода оказывает родостимуляция окситоцином, особенно в тех наблюдениях, когда плод еще до начала родов испытывал гипоксию. Родостимуляция окситоцином приводит к нарушению реактивности сердечно-сосудистой системы плода, снижению его антистрессовой устойчивости, способствует развитию гипердинамического характера схваток, вызывает снижение маточного кровотока. При хронической гипоксии плода окситоцин подавляет сурфактантную систему легких плода, что в свою очередь способствует внутриутробной аспирации околоплодных вод. Кроме того, окситоцин может приводить к нарушению кровообращения у плода и даже к его интранатальной смерти.
При выраженной гипоксии, суб- и декомпенсированной форме фетоплацентарной недостаточности родостимуляция окситоцином представляет опасность для плода.
В этой связи наиболее целесообразным для родостимуляции у рожениц с ФПН является использование препаратов на основе простагландинов Е2 и F2α.
Внутривенное введение препаратов простагландина Е2 применяют в основном в латентную фазу родов или при первичной слабости родовых сил.
При многоводии или плоском плодном пузыре производят раннюю амниотомию при сглаженной шейке матки и раскрытии маточного зева не менее чем на 2—3 см. В процессе ведения родов необходим контроль за опорожнением мочевого пузыря и кишечника.
Препараты на основе простагландина F2α целесообразно применять в активную фазу родов.
При лечении слабости родовых сил возможно использование сочетания препаратов ПГF2α с окситоцином. При комбинированном внутривенном введении оба препарата используют в половинной дозировке (по 2,5 мг и 2,5 ЕД).
Для профилактики аспирационного синдрома у плода при любом виде родостимуляции вводят 10—20 мг седуксена. Обязательным условием родостимуляции является кардиомониторный контроль за состоянием плода. Целесообразно каждые 3—4 ч вводить внутривенно 40 мл 40 % раствора глюкозы с 5 мл 5 % раствора аскорбиновой кислоты и 100 мг кокарбоксилазы.
Если при введении утеротонических препаратов в течение 2 ч не отмечено динамики раскрытия шейки матки или состояние плода ухудшается, то дальнейшее их введение нецелесообразно. В этой ситуации следует решать вопрос в пользу оперативного родоразрешения, метод которого зависит от акушерской ситуации. При слабости родовой деятельности в первом периоде родов, сочетающейся с какой-либо другой патологией (тазовое предлежание плода, отягощенный акушерский анамнез, пожилой возраст роженицы и др.), следует произвести кесарево сечение. Во втором периоде родов следует наложить выходные акушерские щипцы или произвести вакуум-экстракцию.
Наибольшую опасность для плода во время родов при ФПН представляет дискоординация родовой деятельности. При выявлении данного осложнения не следует предпринимать попытки устранения аномальной родовой деятельности, а необходимо решить вопрос в пользу абдоминального родоразрешения.
Нельзя затягивать второй период родов, который должен быть завершен не более чем за 6— 8 потуг.
Необходимо максимально уменьшать механическое воздействие на головку плода. Роды лучше вести без «защиты» промежности, исключить насильственные тракции за головку плода. Следует расширить показания для рассечения промежности.
При неэффективности проводимой терапии и нарастании признаков гипоксии плода в родах, а также при возникновении дополнительных осложнений, усугубляющих акушерскую ситуацию, следует пересмотреть тактику ведения родов в пользу кесарева сечения.
Показаниями к пересмотру тактики ведения родов могут быть:
- ухудшение состояния роженицы или плода;
- возникновение аномалий родовой деятельности (слабость или дискоординация сократительной активности матки);
- нарушение биомеханизма родов;
- выявление признаков диспропорции размеров головки плода и таза матери;
- признаки прогрессирующей ФПН (гипоксии плода).
Для интранатальной оценки состояния фетоплацентарной системы необходимо использование комплексной диагностики, результаты которой оценивают во взаимосвязи с исходным состоянием (накануне родов) матери и плода.
Фетоплацентарная недостаточность. Профилактика
Одно из основных профилактических мероприятий — раннее выявление и взятие на диспансерный учет беременных группы риска по развитию ФПН.
С наступлением беременности следует правильно организовывать режим для пациентки с полноценным отдыхом, включающим сон не менее 8—10 ч, в том числе и дневной в течение 2 ч, а также пребывание на свежем воздухе 3—4 ч.
Важное значение для здоровья матери и правильного развития плода имеет рациональное сбалансированное питание, с адекватным содержанием белков, жиров, углеводов, витаминов и микроэлементов. Потребление жидкости (при отсутствии отеков) для профилактики гиповолемии должно составлять 1—1,5 л.
Важно следить за увеличением массы тела во время беременности. К ее окончанию прибавка массы тела должна составлять в среднем 10,4 кг.
Профилактические мероприятия с применением медикаментозных препаратов у беременных группы риска целесообразно проводить в 14— 16 нед и в 28—34 нед.
Длительность каждого из таких курсов должна составлять 4—6 нед.
Проведение профилактической медикаментозной терапии с началом II триместра обусловлено тем, что в эти сроки беременности происходит наиболее интенсивный рост плода и плаценты, требующий адекватного кровоснабжения и оптимального энергетического обеспечения.
У беременных группы риска уже с этого срока начинает формироваться хроническая плацентарная недостаточность и особенно остро проявляются признаки дезадаптации к развивающейся беременности.
Медикаментозная профилактика усиливает компенсаторно-приспособительные реакции матери и плода, предупреждает дисциркуляторные нарушения МПК и ФПК и морфологические нарушения в плаценте.
Для улучшения маточно-плацентарной гемодинамики, реологических и коагуляционных свойств крови, интенсификации перфузии тканей и снабжение их кислородом в комплексе профилактической терапии используют: агапурин или трентал по 100 мг 3 раза или по 200 мг 2 раза в день после еды; курантил по 25 мг за 1 ч до еды 2 раза в день; аспирин по 80 мг в день. Малые дозы аспирина не сочетают с другими антиагрегантными средствами.
Оптимизация гемодинамики и газообмена обеспечивается за счет применения сосудорасширяющих препаратов и спазмолитиков, особенно у беременных с артериальной гипертензией. С этой целью назначают: коринфар по 10 мг 2 раза в день или верапамил — по 80 мг 2 раза в день; эуфиллин по 0,15 г 2 раза в день или в свечах на ночь; но-шпу по 0,04 г 2—3 раза в день.
Для обеспечения достаточной антиоксидантной защиты и поддержания функции клеточных мембран используют: витамин Е по 100—200 мг 1 раз в день; аскорбиновую кислоту по 0,1 г 3 раза в день.
С целью поддержания функции печени в условиях возрастающей на нее нагрузки целесообразно применять эссенциале форте по 2 капсулы 3 раза в день во время еды.
Для профилактической стимуляции энергетических и обменных процессов назначают: витамин В6 внутримышечно по 1—2 мл 5 % раствора через день; фолиевую кислоту по 400 мкг в день; глутаминовую кислоту принимают внутрь по 0,25 г 2 раза в день; метионин по 0,5 г 3 раза в день; комбинированные поливитаминные препараты, содержащие макро- и микроэлементы (пренатал, прегнавит и др.).
Неотъемлемой частью профилактических мероприятий является определение их эффективности, оценка развития беременности, формирования плаценты, роста и развития плода на основании результатов ультразвукового и лабораторного скрининга.
Беременная должна быть своевременно госпитализирована в акушерский стационар для подготовки организма к родам и решения вопроса о сроке и способе родоразрешения.