Сахарный диабет и беременность
Анатомия и физиология поджелудочной железы
Поджелудочная железа расположена на задней стенке брюшной полости, позади желудка, на уровне LI—LII и простирается от двенадцатиперстной кишки до ворот селезенки. Длина ее составляет около 15 см, масса около 100 г. В поджелудочной железе выделяют головку, расположенную в дуге двенадцатиперстной кишки, тело и хвост, достигающий ворот селезенки и лежащий ретроперитонеально. Поджелудочная железа состоит из экзокринной и эндокринной частей. Эндокринная часть представлена группами эпителиальных клеток (островки Лангерганса), составляющими 3 % от ее массы и отделенных от экзокринной части тонкими соединительнотканными прослойками. Больше всего островков сконцентрировано в области хвоста. Размеры панкреатических островков колеблются в пределах 0,1—0,3 мм, а общая масса их не превышает 1/100 массы поджелудочной железы.
В одном островке содержится от 80 до 200 различных клеток, среди которых α-клетки продуцируют глюкагон, β-клетки — инсулин и D-клетки — соматостатин. Обнаружен еще ряд островковых клеток (РР-клетки), которые предположительно продуцируют вазоактивный интерстициальный полипептид, гастроинтестинальный пептид и панкреатический полипептид.
Основную массу (60 %) составляют β-клетки, располагающиеся в центре островка, остальные клетки расположены по периферии и представлены 25 % α-клеток, 10 % D-клеток и 5 % РР-клеток.
Инсулин образуется в β-клетках из проинсулина в результате его протеолитического расщепления на молекулу С-пептида и молекулу инсулина. Стимулятором секреции инсулина являются глюкоза, аминокислоты (аргинин, лейцин), глюкагон, гастрин, секретин, панкреозимин, желудочный ингибирующий полипептид, сульфаниламидные препараты, β-адреностимуляторы, глюкокортикостероиды, СТГ и АКТГ. Ответ на стимуляцию является двухфазным: первая фаза — быстрая, соответствует выбросу запасов синтезированного инсулина (1-й пул), вторая — медленная (2-й пул), характеризующая скорость его синтеза.
Подавляют секрецию и освобождение инсулина гипогликемия, соматостатин, никотиновая кислота, α-адреностимуляция и фенотиазиды.
Инсулин в крови находится в свободном (иммунореактивный инсулин) и связанном с белками состоянии. Деградация инсулина происходит в печени (до 80 %), почках и жировой ткани под влиянием глутатионтрансферазы и глутатионредуктазы (в печени), инсулиназы (в почках), протеолитических ферментов (в жировой ткани). Проинсулин и С-пептид также подвергаются деградации в печени, но значительно медленнее.
Инсулин оказывает комплексный эффект на инсулинзависимые ткани (печень, мышцы, жировая ткань) и не действует на хрусталик, эритроциты, почечную и нервную ткани. Инсулин является анаболическим гормоном, усиливающим синтез углеводов, белков, нуклеиновых кислот и жира. Его влияние на углеводный обмен выражается в увеличении транспорта глюкозы в клетки инсулинзависимых тканей, стимуляции синтеза гликогена в печени и подавлении гликонеогенеза и гликогенолиза, что вызывает понижение уровня глюкозы в крови. Влияние инсулина на белковый обмен выражается в стимуляции транспорта аминокислот через цитоплазматическую мембрану клеток, синтеза белка и торможения его распада. Участие в жировом обмене характеризуется включением жирных кислот в триглицериды жировой ткани.
Базальная концентрация инсулина, определяемая радиоиммунологически, составляет у здоровых людей 15—20 мкЕД/мл. После пероральной нагрузки глюкозой (100 г) уровень его через 1 ч повышается в 5—10 раз. Скорость секреции инсулина натощак составляет 0,5—1 ЕД/ч, а после приема пищи увеличивается Л° 1,5—5 ЕД/ч.
Другим полипептидным гормоном, синтезируемым в клетках поджелудочной железы, является глюкагон. Он секретируется в ответ на стимуляцию глюкозой, аминокислотами, гастроинтестинальным гормоном и симпатической нервной системой. Образование глюкагона усиливает гипогликемия, аргинин, панкреозимин, физическая нагрузка, а угнетают продукцию — соматостатин, гипергликемия и повышенный уровень свободных жирных кислот в крови. Период полураспада глюкагона составляет 10 мин. Инактивируется он преимущественно в печени и почках.
Основным механизмом действия глюкагона является увеличение продукции глюкозы печенью путем стимуляции его распада и активации гликонеогенеза. Кроме того, связываясь с рецепторами липоцитов, глюкагон способствует гидролизу триглицеридов с образованием глицерина и свободных жирных кислот. Глюкагон стимулирует гликонеогенез в сердечной мышце, что приводит к увеличению сердечного выброса, расширению артериол и уменьшению общего периферического сопротивления, уменьшает агрегацию тромбоцитов, секрецию гастрина, панкреозимина и панкреатических ферментов. Кроме того, глюкагон стимулирует выработку инсулина, СТГ, кальцитонина, катехоламинов, выделение жидкости и электролитов из организма. Базальный уровень секреции глюкагона составляет 50—70 пг/мл. После приема белковой пищи, во время голодания, при хронических заболеваниях печени, ХПН содержание глюкагона увеличивается.
Контраинсулярным гормоном, синтезируемым D-клетками поджелудочной железы, является соматостатин. Наибольшее количество его образуется в гипоталамусе. Биологическая роль соматостатина заключается в подавлении секреции СТГ, АКТГ, ТТГ, гастрина, глюкагона, инсулина, ренина, секретина, вазоактивного желудочного пептида, желудочного сока, панкреатических ферментов. Он тормозит перистальтику желудочно-кишечного тракта, уменьшает освобождение ацетилхолина из нервных окончаний и электровозбудимость нервов. Период полураспада гормона равен 1—2 мин. Содержание соматостатина в плазме крови составляет 10—25 пг/л, повышается у больных сахарным диабетом I типа, акромегалией и при D-клеточной опухоли поджелудочной железы (соматостатиноме).
Роль инсулина, глюкагона и соматостатина в поддержании гомеостаза
Во время голодания уровень инсулина в крови понижается, а глюкагона — повышается в 3—5 раз, особенно на 3—5-й день. Увеличение секреции глюкагона стимулирует распад белка в мышцах и увеличивает процесс гликонеогенеза, что способствует пополнению запасов гликогена в печени и, таким образом, поддержанию постоянного уровня глюкозы в крови. Необходимый для функционирования мозга, эритроцитов, мозгового вещества почек, уровень глюкозы поддерживается за счет усиления гликонеогенеза, гликогенолиза, подавления утилизации глюкозы другими тканями под влиянием увеличения секреции глюкагона и уменьшения потребления глюкозы инсулинзависимыми тканями в результате снижения продукции инсулина. В течение суток мозговая ткань поглощает от 10 до 100 г глюкозы.
Гиперпродукция глюкагона стимулирует липолиз. При длительном голодании источником энергии становятся и кетокислоты, образующиеся в печени. При естественном голодании (в течение ночи) или при длительных перерывах в приеме пищи (6—12 ч) энергетические потребности инсулинзависимых тканей организма поддерживаются за счет жирных кислот, образующихся во время липолиза. После приема пищи (углеводсодержащей) наблюдается быстрое повышение уровня инсулина и уменьшение содержания глюкагона в крови. Первый вызывает ускорение синтеза гликогена и утилизацию глюкозы инсулинзависимыми тканями. Белковая пища стимулирует резкий подъем концентрации в крови глюкагона (на 50—100 %) и незначительное увеличение количества инсулина, что способствует усилению гликонеогенеза и увеличению продукции глюкозы печенью.
Классификация и патогенез сахарного диабета
Сахарный диабет — это синдром хронической гипергликемии и глюкозурии, обусловленный абсолютной или относительной инсулиновой недостаточностью, сочетающийся со специфическими микро- и макрососудистыми осложнениями, нейропатией и другими патологическими изменениями в различных органах и тканях.
По этиологической классификации экспертов ВОЗ (1999) различают следующие типы сахарного диабета.
- Сахарный диабет I типа (деструкция β-клеток, обычно приводящая к абсолютной инсулиновой недостаточности):
- аутоиммунный;
- идиопатический.
- Сахарный диабет II типа (от преимущественной резистентности к инсулину с относительной инсулиновой недостаточностью до преимущественного секреторного дефекта с инсулиновой резистентностью или без нее).
- Другие генетические синдромы, иногда сочетающиеся с диабетом (синдром Дауна, Клайнфельтера, Шерешевского — Тернера, порфирия, миотоническая дистрофия).
- Гестационный диабет.
Чаще всего встречаются тип I и тип II, основные различия которых представлены в табл. 1.
Таблица 1. Основные различия сахарного диабета I и II типа
| Признак I | Диабет типа I | Диабет типа II |
| Возраст к началу заболевания | Молодой, обычно до 30 лет, пик — пубертат | Старше 40 лет |
| Начало болезни | Острое | Постепенное (месяцы) |
| Масса тела | Снижена | Ожирение |
| Пол | Чаще мужчины | Чаще женщины |
| Выраженность клинических признаков | Резкая | Умеренная |
| Течение диабета | Лабильное | Стабильное |
| Кетоацидоз | Возможен | Не развивается |
| Уровень кетоновых тел в крови | Часто повышен | В пределах нормы |
| Анализ мочи | Наличие глюкозы и ацетона | Наличие глюкозы |
| Сезонность начала заболевания | Осенне-зимний период | Отсутствует |
| Инсулин и С-пептид плазмы | Инсулинопения и снижение С-пептида | В норме или гиперинсулинемия |
| Состояние поджелудочной железы | Уменьшение количества β-клеток, их дегрануляция, снижение или отсутствие в них инсулина, островок состоит из α-, D- и РР-клеток | Количество островков и процентное содержание β-, α-, D-и РР-клеток в пределах возрастной нормы |
| Антитела к островкам поджелудочной железы | Обнаруживаются в первые недели болезни | Отсутствуют |
| Лимфоциты и другие клетки воспаления в островке (инсулит) | Присутствуют в первые недели заболевания | » |
| Генетические маркеры | Сочетание с HLA-DR3, DR4, DQA1, DQB1 | Гены системы HLA не отличаются от здоровой популяции |
| Конкордантность у монозиготных близнецов | Менее 50 % | Более 90 % |
| Частота диабета у родственников | Меньше 10 % | Более 20 % |
| Лечение | Диета, инсулин | Диета, пероральные сахароснижающие препараты, реже инсулин |
| Поздние осложнения | Микроангиопатии | Макроангиопатии |
Под влиянием некоторых внешних факторов (вирусы Коксаки, краснухи, эпидемического паротита, нитрозамины, различные экзогенные соединения) Т-лимфоциты приобретают аномальную чувствительность к различным белкам островка поджелудочной железы, выступающим в качестве аутоантигенов. Кроме того, происходит активация иммунокомпетентных клеток, повышается образование различных цитокинов (ИЛ-1, ФНО), простагландинов, оксида азота, совокупное действие которых приводит к деструкции, уменьшению количества β-клеток и развитию аутоиммунного процесса. Таким образом, независимо от инициирующих агентов на последующих этапах в островках наблюдается деструкция и прогрессирующее уменьшение количества β-клеток вплоть до полного их исчезновения и развития абсолютной инсулиновой недостаточности.
Патогенез сахарного диабета I типа можно разделить на шесть стадий, медленно прогрессирующих и переходящих одна в другую.
- Генетическая предрасположенность, обусловленная наличием определенных гаплотипов HLA-системы I, II и III классов, а также других диабетогенных генов (IDDM 1—24).
- Инициация иммунных процессов (наличие в сыворотке крови таких лиц только одного вида антител к антигенам островка поджелудочной железы).
- Стадия активных иммунологических процессов (наличие 3 или 4 типов антител к антигенам островка поджелудочной железы, а также антител к клеткам других эндокринных органов и тканей).
- Прогрессивное снижение первой фазы секреции инсулина, стимулированной внутривенным введением глюкозы.
- Клинически явный или манифестный диабет (гипергликемия и другие симптомы диабета возникают при явлениях абсолютной инсулиновой недостаточности, а в поджелудочной железе при этом наблюдается деструкция и гибель 85— 90 % β-клеток, а при определении инсулина и С-пептида в сыворотке крови еще определяется остаточная секреция инсулина).
- Полная деструкция β-клеток.
Действие генетических факторов в патогенезе сахарного диабета II типа играет более значимую роль, чем при диабете I типа. Однако наличие генетической предрасположенности к развитию сахарного диабета еще не означает 100 % вероятность его развития. Значительную роль играет наличие негенетических внешних факторов. Генетическая предрасположенность важна для нарушения толерантности к глюкозе, тогда как в развитии сахарного диабета ведущая роль принадлежит внешним факторам, на фоне которых и развивается клиника.
Сахарный диабет II типа является гетерогенным и полигенным заболеванием, в патогенезе которого участвуют несколько генетических и внешнесредовых компонентов. Гены, определяющие предрасположенность к сахарному диабету II типа, оперируют уже на эмбриональных стадиях развития поджелудочной железы, а также вовлечены в процессы секреции инсулина и обмена глюкозы в β-клетке, печени и других тканях. Главным механизмом развития сахарного диабета II типа являются развитие инсулиновой резистентности и недостаточность функции β-клеток.
Основной из причин вторичной инсулиновой резистентности является глюкозотоксичность как следствие длительной гипергликемии. Помимо этого, глюкозотоксичность способствует десентизации β-клеток, что проявляется ухудшением их секреторной активности. Свободные жирные кислоты оказывают ингибирующее действие на окисление глюкозы и участвуют в поддержании и усилении состояния инсулинорезистентности. Кроме того, увеличение концентрации в крови ненасыщенных жирных кислот и триглицеридов сочетается с резким увеличением их содержания в островках.
Ингибирующее влияние липидов на функцию β-клеток обозначается как липотоксичность.
При сахарном диабете II типа возможно как снижение количества и аффинности рецепторов к инсулину, так и нарушение инсулинорецепторного взаимодействия, что сопровождается усилением клинических проявлений инсулинорезистентности. Помимо рецепторных, известен целый ряд пострецепторных механизмов, участвующих как в генезе инсулинорезистентности, так и в механизмах развития диабета.
Развитие сахарного диабета II типа можно представить в виде процесса, проходящего следующие фазы.
- Наличие первичной инсулинорезистентности и других генетически обусловленных нарушений, способствующих снижению биологического действия инсулина.
- Хорошая адаптация островкового аппарата поджелудочной железы к повышенной потребности в инсулине, что сопровождается гиперплазией β-клеток.
- Умеренная декомпенсация островкового аппарата, проявляющаяся нарушением гликемии натощак и нарушенной толерантностью к углеводам.
- Выраженная декомпенсация β-клеток, сопровождающаяся клинической манифестацией сахарного диабета.
- Декомпенсация, сопровождающаяся структурными изменениями β-клеток и недостаточностью секреции инсулина, что клинически проявляется в виде инсулиноподобного подтипа сахарного диабета II типа.
Помимо сахарного диабета II типа, инсулинорезистентность может сопутствовать и некоторым другим состояниям.
Причины инсулинорезистентности следующие:
Физиологическая:
- пубертатный возраст;
- беременность;
- ночной сон;
- диета, богатая жирами.
Метаболическая:
- диабет II типа;
- декомпенсация диабета I типа;
- диабетический кетоацидоз;
- ожирение;
- выраженная недостаточность питания;
- гиперурикемия;
- избыточный прием алкоголя.
Эндокринная:
- тиротоксикоз;
- гипотиреоз;
- синдром Кушинга;
- акромегалия;
- феохромоцитома.
Неэндокринная:
- эссенциальная гипертензия;
- ХПН;
- ревматоидный артрит;
- сердечная недостаточность;
- травма, ожоги, сепсис;
- хирургические вмешательства;
- раковая кахексия.
Диагностика и клиническая картина сахарного диабета
Нормальным содержанием глюкозы в крови считается уровень до 6,1 ммоль/л; нарушенная гликемия натощак — содержание глюкозы от 6,1 до 7,0 ммоль/л; уровень глюкозы более 7,0 расценивается как предварительный диагноз сахарного диабета, который должен быть подтвержден повторным определением содержания глюкозы в крови.
При выявлении повышенного уровня глюкозы в крови необходимо проводить нагрузочные тесты для выявления степени толерантности к глюкозе. Для этих целей используют пероральный глюкозотолерантный тест, отправными показателями которого являются:
- нормальная толерантность к глюкозе через 2 ч после нагрузки характеризуется уровнем гликемии менее 7,8 ммоль/л;
- о нарушенной толерантности к глюкозе свидетельствует повышение концентрации глюкозы в плазме крови через 2 ч после нагрузки глюкозой до 7,8 ммоль/л и более, но ниже 11,1 ммоль/л;
- предварительный диагноз сахарного диабета может быть установлен при содержании глюкозы в плазме венозной крови более 11,1 ммоль/л через 2 ч после нагрузки глюкозой.
Таким образом, диагноз сахарного диабета может быть установлен при повышении уровня глюкозы в плазме крови натощак более 7,0 ммоль/л и в капиллярной крови более 6,1 ммоль/л.
В зависимости от уровня глюкозы в крови различают 3 степени тяжести сахарного диабета.
I степень (легкая): гипергликемия натощак менее 7,7 ммоль/л, нет признаков кетоза, нормализация уровня глюкозы в крови может быть достигнута с помощью одной диеты.
II степень (средняя): гипергликемия натощак менее 12,7 ммоль/л, нет признаков кетоза, для нормализации уровня глюкозы в крови необходимо использование инсулина в дозах не превышающих 60 ЕД/сут.
III степень (тяжелая): гипергликемия натощак более 12,7 ммоль/л, выражены кетоацидоз, микроангиопатии, для нормализации уровня глюкозы в крови требуются дозы инсулина, превышающие 60 ЕД/сут.
Сахарный диабет I типа обычно бывает средней и тяжелой формы, а сахарный диабет II типа — легкой или средней тяжести.
На фоне инсулинотерапии критериями компенсации для всех видов диабета являются:
- гликемия натощак менее 5,3 ммоль/л;
- гликемия через 1 ч после еды менее 7,8 ммоль/л;
- гликемия через 2 ч после еды менее 6,7 ммоль/л.
Дополнительным показателем, который может быть использован для диагностики сахарного диабета является уровень гликозилированного (гликированного) гемоглобина. В норме он не превышает 6—7 % от общего количества гемоглобина крови, а при сахарном диабете зачастую превышают 10 %. Гликозилированный гемоглобин позволяет оценить уровень глюкозы в крови на протяжении последних 1,5—2 мес, так как именно этот промежуток времени необходим для гликирования гемоглобина в действующих и образующихся эритроцитах. Однако при беременности этот показатель не является достоверным в связи со снижением уровня глюкозы в крови и уменьшением продолжительности жизни эритроцитов.
Помимо анализа крови, для диагностики сахарного диабета можно использовать исследование мочи. В моче здорового человека глюкоза отсутствует, а глюкозурия появляется только в случае, когда уровень глюкозы в крови превышает 8,8— 9,9 ммоль/л. Однако при беременности возможно появление глюкозурии в результате изменений фильтрационной функции почек. Глюкозурия встречается достаточно часто и при беременности не имеет большого диагностического значения. Кроме глюкозы, в моче может определяться ацетон, что является косвенным признаком декомпенсации сахарного диабета. Параллельное с этим увеличение количества кетоновых тел (ацетон, ацетоуксусная и β-оксимасляная кислоты) в крови подтвердит диагноз сахарного диабета.
Одним из тестов адекватности лечения является определение в сыворотке крови больных уровня С-пептида, поскольку этот показатель позволяет оценить количество эндогенного инсулина. Измеряя количество С-пептида, можно установить, в какой мере функция поджелудочной железы подавлена экзогенным инсулином. У больных сахарным диабетом уровень С-пептида до и после нагрузки свидетельствует о степени резистентности или чувствительности к инсулину.
Клиническая картина сахарного диабета проявляется двояко. Это обусловлено острым или хроническим дефицитом инсулина, который в свою очередь может быть абсолютным и относительным. Острый дефицит инсулина вызывает состояние декомпенсации углеводного и других видов обмена, сопровождающейся клинически значительной гипергликемией, глюкозурией, полиурией, полидипсией, похуданием на фоне гиперфагии, кетоацидозом, вплоть до диабетической комы. Хронический дефицит инсулина на фоне субкомпенсированного и периодически компенсированного течения сахарного диабета сопровождается клиническими проявлениями, характеризующимися как «поздний диабетический синдром» (диабетическая ретино-, нейро- и нефропатия), в основе которых лежат диабетическая микроангиопатия и метаболические нарушения, типичные для хронического течения заболевания.
Диабет I типа, как правило, проявляется выраженной клинической симптоматикой, отражающей характерный для него дефицит инсулина в организме. Началу заболевания свойственны метаболические нарушения, вызывающие клинические признаки декомпенсации сахарного диабета (полидипсию, полиурию, похудание, кетоацидоз), развивающиеся в течение нескольких месяцев или дней. Нередко болезнь впервые проявляется диабетической комой или тяжелым ацидозом, однако на фоне адекватной инсулинотерапии в большинстве случаев удается добиться ремиссии заболевания с отменой инсулина на несколько лет. Спустя несколько месяцев, а иногда и 2—3 лет, болезнь возобновляется, и инсулинотерапия становится необходимой на протяжении всей жизни. Такая ситуация в эндокринологии получила название «медовый месяц диабетика». Ее длительность зависит от двух факторов: степени повреждения р-клеток поджелудочной железы и ее способности к регенерации. В зависимости от преобладания одного из этих факторов заболевание может сразу принять характер клинического диабета или произойдет ремиссия. На длительность ремиссии дополнительно влияют такие внешние факторы, как частота и тяжесть сопутствующих вирусных инфекций.
По мере увеличения длительности заболевания (через 10—20 лет) появляются клинические проявления позднего диабетического синдрома в виде ретино- и невропатии, которые прогрессируют медленнее при хорошей компенсации сахарного диабета. Основной причиной летального исхода является почечная недостаточность и значительно реже — осложнения атеросклероза.
Таблица 2. Дифференциальная диагностика ком
| Признак | Диабетическая кома | Гипогликемическая кома |
| Скорость нарастания симптомов | Постепенно, в течение нескольких дней, реже часов | Быстро, в течение нескольких часов |
| Запах ацетона изо рта | Резкий | Отсутствует |
| Дыхание | Шумное, Куссмауля | Нормальное |
| Кожа | Сухая, тургор понижен | Влажная, тургор нормальный |
| Тонус глазных яблок | Понижен | Нормальный |
| Мышечный тонус | Снижен | » |
| Сухожильные рефлексы | Снижены или отсутствуют | Нормальные |
| Пульс | Частый | Частый, нормальный, замедленный |
| Артериальное давление | Снижено | Нормальное |
| Глюкоза в моче | В большом количестве | Отсутствует |
| Ацетон в моче | То же | » |
| Глюкоза в крови | Более 19,4 ммоль/л | Менее 2,2 ммоль/л |
| Уровень кетоновых тел в крови | Повышен | Нормальный |
| Количество лейкоцитов в крови | Увеличено | Нормальное |
| Щелочной резерв крови | Снижен | Нормальный |
Клиническое течение сахарного диабета II типа характеризуется постепенным началом, без признаков декомпенсации. Больные чаще обращаются к дерматологу, гинекологу, невропатологу по поводу грибковых заболеваний, фурункулеза, эпидермофитии, зуда во влагалище, болей в ногах, пародонтоза, нарушения зрения. Течение сахарного диабета стабильное, без склонности к кетоацидозу и гипогликемическим состояниям на фоне применения только диеты или в сочетании с сахароснижающими пероральными препаратами.
Сахарный диабет протекает с микроангиопатиями — генерализованным дегенеративным поражением мелких сосудов (капилляров, артериол, венул). После 30—40 лет присоединяется диабетическая макроангиопатия, поражающая сосуды среднего и крупного калибра. Особенно опасна диабетическая ретинопатия, сопровождающаяся прогрессирующим падением остроты зрения, кровоизлиянием в сетчатку и стекловидное тело и угрожающая слепотой. Ретинопатия отмечается у 30—90 % больных.
Диабетическая нефропатия проявляется узелковым интракапиллярным гломерулосклерозом у 10—90 % больных.
Этот синдром характеризуется ретинопатией, артериальной гипертензией, протеинурией, отеками, гиперазотемией. Хроническая почечная недостаточность при диабетической нефропатии развивается раньше, чем при других хронических заболеваниях почек — через 9,5 лет от начала болезни. При сахарном диабете наблюдается ослабление иммунной системы, что проявляется снижением количества и качества Т-лимфоцитов и депрессией фагоцитоза. Все это способствует развитию различной инфекционной патологии, чаще всего локализованной в урогенитальной области (пиелонефрит, цистит).
Опасным осложнением, развивающимся при сахарном диабете, являются коматозные состояния: кетонемическая и гипогликемическая комы. Гиперосмолярная кома развивается у лиц старше 50 лет, поэтому у беременных не встречается. Гипергликемические состояния во время беременности возникают реже, чем до нее, а гипогликемические — значительно чаще (табл. 2).
Физиологические изменения углеводного обмена при беременности
При физиологической беременности углеводный обмен изменяется в соответствии с большими потребностями плода в энергоматериале, главным образом в глюкозе. Нормальная беременность характеризуется снижением толерантности к глюкозе и чувствительности тканей к инсулину, усиленным распадом инсулина и увеличением концентрации свободных жирных кислот. В результате описанных изменений в крови повышается концентрация инсулина и снижается уровень глюкозы.
Изменения углеводного обмена связаны с контринсулярным влиянием плацентарных гормонов: плацентарного лактогена, эстрогенов, прогестерона, а также кортикостероидов. Благодаря этому поддерживается необходимый для развития и функционирования фетоплацентарного комплекса уровень глюкозы в крови.
Глюкоза проходит через плаценту путем облегченной диффузии, в то время как для материнского инсулина она непроницаема. В норме уровень глюкозы в плазме у плода примерно на 0,6—1,1 ммоль/л ниже, чем у матери. К 10—12 нед беременности поджелудочная железа плода начинает секретировать собственный инсулин и глюкагон, гипергликемия у матери стимулирует секрецию плодового инсулина.
На протяжении беременности потребность в инсулине значительно меняется. Это происходит в результате усиленного поглощения глюкозы плацентой и торможения гликонеогенеза. В первой половине беременности чувствительность тканей материнского организма к инсулину повышается. Плацентарные гормоны (в частности, плацентарный лактоген) усиливают липолиз, что приводит к повышению глицерина и свободных жирных кислот в плазме. Следствием этого является усиление кетогенеза и развитие гиперкетонемии. Кетоновые тела свободно проходят через плаценту и также используются плодом как источник энергии. При недостатке поступления глюкозы из организма матери, особенно при токсикозе первой половины беременности, даже у здоровой женщины в моче может появиться ацетон.
Во второй половине беременности значительно возрастает количество плацентарных гормонов, которые подавляют утилизацию глюкозы тканями матери. Поэтому у беременных уровень глюкозы после приема пищи выше, чем у небеременных. Плацентарные гормоны способствуют развитию физиологической инсулинорезистентности. Считается, что опосредованное беременностью снижение чувствительности к инсулину благоприятствует росту плода, так как обеспечивает поступление глюкозы в фетоплацентарную систему. Этот процесс называется усиленным анаболизмом. Описанные изменения связаны, во-первых, с увеличением размеров β-клеток поджелудочной железы, соответствующим увеличению срока беременности, во-вторых, при беременности повышается резистентность тканей к инсулину, что является компенсаторным механизмом, обеспечивающим поддержание нормального уровня глюкозы в условиях гиперинсулинизма. Под влиянием гормонов плаценты развивается инсулинорезистентность, клинически проявляющаяся увеличением потребности в инсулине — примерно до 50 % по сравнению с таковой до беременности.
Кроме повышения уровня плацентарных гормонов, включаются и другие диабетогенные факторы, поддерживающие инсулинорезистентность. К ним относятся повышенный уровень пролактина, кортизола и разрушение инсулина плацентарными ферментами. Таким образом, беременность представляет собой физиологический стрессовый тест и сохранение нормальной толерантности к глюкозе возможно при наличии достаточного запаса материнских β-клеток.
Течение сахарного диабета при беременности
Во время беременности течение сахарного диабета существенно изменяется. Можно выделить 3 стадии этих изменений.
- В I триместре беременности происходит улучшение течения болезни, уменьшается уровень глюкозы в крови, повышается чувствительность тканей к инсулину, что может привести к развитию гипогликемии. Поэтому доза инсулина должна быть уменьшена на 1/3.
- С 13 нед беременности наблюдается ухудшение течения болезни, рост гипергликемии, что может привести к кетоацидозу и прекоме. Дозу инсулина необходимо увеличить, поскольку потребность в нем возрастает вследствие контринсулярного влияния плацентарных гормонов. С 32 нед беременности и до родов возможно улучшение течения диабета и появление гипогликемии. Поэтому дозу инсулина уменьшают на 20—30 %. Улучшение состояния связывают с влиянием инсулина плода на организм матери, а также с повышенным потреблением плодом глюкозы, которая поступает через плаценту из материнской крови.
- В родах происходят значительные колебания уровня глюкозы в крови, могут развиться гипергликемия и ацидоз под влиянием эмоциональных воздействий или гипогликемии как следствия проделанной физической работы, утомления женщины. После родов глюкоза крови быстро снижается и затем постепенно повышается. Максимум снижения уровня ее и в связи с этим дозы инсулина приходится на 2—3-й день, затем дозу инсулина увеличивают, и к 7— 10-му дню послеродового периода она достигает той, что была до беременности.
В доинсулиновую эру роды у женщин с сахарным диабетом были редкостью, беременность наступала только у 5 % и угрожала их жизни, неонатальная смертность достигала 60 %. Лечение инсулином позволило подавляющему большинству больных диабетом женщин иметь детей, смерть женщин стала редкостью (1—2 %). Однако перинатальная смертность остается достаточно высокой, достигая 20—30 %, но при рациональной тактике лечения и ведения беременности она может быть сокращена до 2—3 %. Распространенность сахарного диабета среди беременных составляет 0,5 %, причем это число ежегодно увеличивается в связи с аналогичной тенденцией, наблюдаемой в популяции.
Течение беременности при сахарном диабете сопровождается рядом особенностей, которые чаще всего являются следствием сосудистых осложнений у матери и зависят от формы заболевания и степени компенсации нарушений углеводного обмена.
В результате склеротических и трофических изменений в артериолах и венулах матки не происходит полноценной гестационной перестройки эндо- и миометральных сегментов маточных артерий. Отсутствуют условия для реализации первой и второй волн инвазии цитотрофобласта, что создает предпосылки для развития первичной фетоплацентарной недостаточности и гестоза.
Гестоз развивается у 30—79 % женщин и проявляется преимущественно гипертензией и отеками, но нередки и тяжелые формы вплоть до эклампсии. При сочетании гестоза и диабетической нефропатии опасность для жизни матери резко возрастает, так как может развиться уремия. Частота мертворождения при гестозе составляет 18—46 %. Для развития тяжелых форм гестоза неблагоприятными прогностическими признаками являются:
- длительность заболевания более 10 лет;
- лабильное течение сахарного диабета до наступления данной беременности;
- наличие диабетической ангиоретинопатии и полиневропатии;
- инфекции мочевыводящих путей на фоне беременности.
В результате недостаточного уровня инсулина в крови происходит снижение синтетических функций организма и уменьшается продукция плазменных факторов свертывания крови, гепарина и как следствие — активности антитромбина III, что нарушает баланс между тромбообразованием и активностью антитромботических субстанций. В результате этот процесс проявляется в повышении коагуляционного потенциала, развитии ДВС-синдрома, что приводит к тромботическим осложнениям, развитию и/или усугублению ФПН и прерыванию беременности.
При сахарном диабете повышается риск самопроизвольного выкидыша, многоводия, пороков развития плода, ЗВУР плода, макросомии и смерти плода. Степень риска осложнений в значительной степени зависит от поддержания нормального уровня глюкозы плазмы у матери во время беременности.
Пороки развития — самая частая причина смерти новорожденных, матери которых больны сахарным диабетом. Чаще поражаются ЦНС, сердце, кости, желудочно-кишечный тракт и мочевые пути. Причиной пороков является гипоксическое повреждение тканей желточного мешка в течение первых 4—6 нед беременности, обусловленное гипергликемией. Наиболее высок риск повреждения нервной трубки (в 9 раз выше, чем при нормальной беременности) и сердца (в 5 раз чаще). Несовместимые с жизнью пороки развития встречаются в 2,6 % случаев. Врожденные пороки развития наблюдаются в 2—4 раза чаще, чем при нормальной беременности, а пороки, несовместимые с жизнью, составляют 40 % причин перинатальной смерти. Факторами риска их возникновения при сахарном диабете I типа являются плохой контроль диабета до зачатия, длительность болезни свыше 10 лет и диабетическая патология сосудов. Самопроизвольное прерывание беременности при этом происходит у 15—31 % женщин в 20—27 нед беременности и раньше. Риск самопроизвольного прерывания выше, если количество гликозилированного гемоглобина в первые 3 мес беременности превышает 12 %, а количество глюкозы в крови натощак превышает 6,7 ммоль/л.
В III триместре беременности возможно развитие задержки внутриутробного развития, макросомии и смерти плода, что непосредственно связано с гипоксией и ацидозом вследствие гипергликемии и фетоплацентарной недостаточности. Патогенез макросомии до конца неясен. Вероятно, она обусловлена избыточным отложением жира в подкожной жировой клетчатке и увеличением размеров печени плода вследствие гипергликемии. Размеры головки и головного мозга плода остаются в пределах нормы. При макросомии затрудняется прохождение массивного плечевого пояса плода по родовым путям, что может привести к родовой травме и даже смерти плода.
Задержка внутриутробного развития наблюдается реже, чем смерть плода и макросомия. В основе патогенеза ЗВУР лежит плацентарная недостаточность, развивающаяся на фоне диабетической микроангиопатии.
Еще одним частым осложнением беременности, развивающимся на фоне сахарного диабета, является многоводие, которое диагностируется у 20—60 % женщин. В патогенезе многоводия играют роль полиурия плода и реакция его амниона в ответ на повышенное содержание глюкозы в околоплодных водах. Кроме того, снижается гормонпродуцирующая функция плаценты, уменьшается маточно-плацентарное кровообращение, что приводит к ухудшению состояния плода, снижению его жизнедеятельности, развитию дистресс-синдрома, диабетической фетопатии, множественным порокам развития плода и его внутриутробной смерти. При многоводии обычно на 36—38-й неделе беременности у 29 % пациенток отмечается внутриутробная смерть плода, которую связывают с нарастающей аноксией, обусловленной ишемией плаценты в результате механического давления околоплодных вод.
На фоне сахарного диабета происходят значительные изменения местного и общего иммунитета, что наряду с глюкозурией способствует развитию инфекций мочевыводящих путей у 16 % беременных. Бессимптомная бактериурия у пациенток с сахарным диабетом встречается в 2— 3 раза чаще, чем в популяции, а клинически выраженный пиелонефрит диагностируется у 6 %.
При нарушении механизмов компенсации углеводного обмена во время беременности у 12 % женщин возможно развитие гестационного сахарного диабета. Этот тип сахарного диабета встречается у 50—90 % беременных с эндокринной патологией, а у 25—50 % женщин с гестационным сахарным диабетом со временем развивается истинный сахарный диабет II типа.
Гестационный сахарный диабет — это нарушение толерантности к углеводам различной степени тяжести с началом и первым проявлением во время беременности. Заболевание нередко протекает бессимптомно и выявляется только при лабораторном исследовании, чаще после 24—26 нед беременности, когда наиболее выражена инсулинорезистентность. Гипергликемия, выявленная в I триместре беременности, чаще всего свидетельствует о манифестировании истинного сахарного диабета, начавшегося до беременности.
В группу риска по развитию гестационного диабета входят женщины:
- с отягощенной по сахарному диабету наследственностью;
- с наличием гестационного сахарного диабета в анамнезе;
- с глюкозурией или клиническими симптомами сахарного диабета во время предыдущей или данной беременности;
- с уровнем глюкозы в капиллярной крови натощак выше 5,5 ммоль/л или через 2 ч после еды более 7,8 ммоль/л;
- с ожирением;
- если масса тела предыдущего ребенка при рождении более 4000 г;
- с привычным невынашиванием в анамнезе, необъяснимой смертью плода или врожденными аномалиями его развития;
- с многоводием и/или макросомией плода;
- с возрастом более 35 лет;
- с артериальной гипертензией;
- с тяжелыми формами гестоза в анамнезе;
- с рецидивирующим кольпитом.
Предполагается, что при ожирении уменьшается число рецепторов к инсулину на поверхности эффекторных клеток, что и приводит к снижению связывания и уменьшению эффекта этого гормона. Следовательно, при беременности у лиц с повышенной массой тела действие плацентарных гормонов может привести к усилению инсулинорезистентности и в результате к развитию гестационного сахарного диабета.
На фоне сахарного диабета, прежде всего со II триместра беременности, выявляются особенности в развитии и росте плода, которые к 24— 26-й неделе четко разделяются на 3 типичные картины. Первая характеризуется задержкой внутриутробного развития плода и заканчивается рождением к сроку гестации маловесного ребенка с нечетко выраженными признаками диабетической фетопатии. Вторая клиническая картина развивается с 26—28-й недели и не отличается от популяционной нормы. Беременность заканчивается рождением детей средних размеров без выраженных признаков диабетической фетопатии. Третья, начиная с 26 нед беременности, характеризуется значительным превышением популяционных норм и заканчивается рождением детей с макросомией и выраженными признаками диабетической фетопатии.
В итоге плод при сахарном диабете нормально не развивается. В основном у него поражается ЦНС, которая отстает в развитии. Увеличение живота у плода происходит за счет увеличения печени, в которой осуществляются сложные процессы метаболизма, развиваются экстрамедуллярные очаги кроветворения и отек. Из-за повышенной гидрофильное™ тканей наблюдается отечность передней брюшной стенки и конечностей. Имеются изменения сердечной деятельности, о которых свидетельствуют нарушения роста груди за счет кардиомегалии. Плод растет неравномерно, его рост то замедляется, то ускоряется, что обусловлено периодами гипер- и гипогликемии у матери и связанными с этим изменениями гормонального профиля.
Перинатальная смертность при сахарном диабете I типа составляет 202 ‰, II типа — 47 ‰, гестационного диабета — 95 ‰. Причинами повышенной заболеваемости плода являются макросомия, гипогликемия, врожденные пороки сердца, синдром дыхательных расстройств, тяжелая степень гипербилирубинемии, гипокальциемия, полицитемия. Важнейшая причина смерти плода — синдром дыхательной недостаточности, так как на фоне гиперинсулинемии нарушается синтез сурфактанта в легочной ткани.
Рождение здорового ребенка в значительной степени зависит от правильного функционирования механизмов, которые своевременно запускают родовую деятельность, а затем обеспечивают самопроизвольное родоразрешение. Тяжелое течение и поздние осложнения сахарного диабета, многоводие, гестоз и урогенитальные инфекции являются основными причинами преждевременных родов у беременных с сахарным диабетом. Их частота зависит от типа сахарного диабета и составляет от 25 до 60 %. Частота преждевременных родов у пациенток с сахарным диабетом I типа составляет 60 %, своевременная самопроизвольная родовая деятельность развивается только у 23 % женщин. Примерно в 20 % случаев роды проводят оперативно в связи с острым развитием многоводия и критическим состоянием плода.
Наиболее частое осложнение в родах у пациенток с сахарным диабетом — дородовое излитие околоплодных вод, частота которого достигает 40 %, что в большинстве случаев вызвано наличием урогенитальной инфекции и изменениями в околоплодных оболочках. В результате выраженных метаболических расстройств, тканевой гипоксии и патологии функционирования нервной системы в 30 % случаев развивается слабость родовой деятельности.
Крупные размеры, нарушение пропорции между головкой и шириной плечиков плода, а также присоединяющаяся слабость потуг создают трудности в выведении плечевого пояса и способствуют развитию дистоции плечиков плода в 13 % случаев.
Таблица 3. Частота фенотипических признаков диабетической фетопатии
| Признак | Частота, % |
| Избыточная масса | 22 |
| Одутловатость | 26 |
| Лунообразное лицо | 59 |
| Короткая шея | 41 |
| Заплывшие глаза | 21 |
| Общая пастозность | 83 |
| Выраженный плечевой пояс | 19 |
| Гипертрихоз | 27 |
| Кардиомиопатия | 32 |
| Гепатомегалия | 66 |
| Спленомегалия | 15 |
| Нависающий лоб | 3 |
| Длинное туловище | 14 |
| Короткие конечности | 25 |
Новорожденные от матерей с сахарным диабетом, несмотря на большую массу тела, рассматриваются как недоношенные и нуждающиеся в специальном уходе. В первые часы жизни внимание должно быть обращено на выявление и борьбу с респираторными расстройствами, гипогликемией, ацидозом и поражением ЦНС. Риск макросомии у плода значительнее при концентрации глюкозы в крови беременной выше 7,2 ммоль/л. Другая крайность — гипотрофия плода — встречается при сахарном диабете I типа в 20 % случаев.
Основная ее причина — это васкулопатии и гестоз, но и маловесные дети и новорожденные с макросомией имеют те или иные признаки диабетической фетопатии.
Диабетическая фетопатия — это заболевание, которое проявляется комплексом фенотипических признаков, развившимся внутриутробно у плода в процессе гестации. Есть основания полагать, что эти изменения возникают с начальных сроков беременности, когда происходит закладка органов и систем, под влиянием гормональной стимуляции (недостаток инсулина, повышенная функция надпочечников, изменения функции щитовидной железы) и метаболизма (гипергликемия, гипопротеинемия).
К фенотипическим относятся по крайней мере 14 признаков диабетической фетопатии, которые встречаются с разной частотой и в различных сочетаниях (табл. 3).
Наиболее часто встречаются такие признаки, как пастозность мягких тканей, гепатомегалия, лунообразное лицо, короткая шея, избыточная масса тела. Дети у женщин с сахарным диабетом рождаются крупными за счет избыточного отложения жировой ткани (масса более 4500 г, рост 55—60 см). Причем, чем тяжелее состояние детей при рождении и в последующие дни, тем более выражены признаки диабетической фетопатии.
У маловесных детей с синдромом задержки внутриутробного развития и микросомией преобладают общая пастозность, гепатомегалия, короткая шея и гипертрихоз. При этом гипертрофия одних органов (сердца, надпочечников, печени, почек) может сочетаться с уменьшением массы других (мозг и вилочковая железа).
У 50 % новорожденных от матерей с сахарным диабетом в раннем неонатальном периоде отмечается синдром дисглюкоземии. Проявления этого синдрома в виде гипо- и гипергликемии зависят от тяжести и степени компенсации основного заболевания матери, наличия осложнений беременности (гестоз) и родов (травмы), характера нарушений адаптации новорожденных в раннем постнатальном периоде.
Дети с диабетической фетопатией значительно хуже адаптируются в раннем неонатальном периоде, что выражается развитием конъюгационной желтухи, токсической эритемы, значительной потерей массы тела и медленным ее восстановлением.
Таким образом, описанные выше осложнения беременности определяют целесообразность своевременного выявления, коррекции сахарного диабета и планирования беременности с целью снижения материнской и младенческой заболеваемости и смертности.
Планирование беременности у женщин с сахарным диабетом
Планирование беременности у женщин с сахарным диабетом является обязательным и необходимым условием для рождения здорового ребенка. В связи с этим необходимо придерживаться следующих постулатов.
- До достижения стабильной ремиссии сахарного диабета следует воздержаться от беременности. Сахарный диабет считают компенсированным, если уровень гликозилированного гемоглобина находится в пределах нормы (до 6—7 %), а уровень глюкозы плазмы натощак составляет 3,3—5,0 ммоль/л, через 1 ч после приема пищи — не выше 7,8 ммоль/л, а через 2 ч после приема пищи — не выше 6,7 ммоль/л.
- Поскольку пероральные сахаропонижающие средства могут оказывать тератогенное действие, их заменяют на инсулин, причем переход на инсулинотерапию лучше провести до наступления беременности.
- Женщины с сахарным диабетом должны придерживаться индивидуально разработанной диеты, полностью покрывающей потребности матери и плода.
- Учитывая полигиповитаминоз, развивающийся на фоне сахарного диабета, женщины должны получать в достаточном количестве витамины и микроэлементы.
- При сборе анамнеза и проведении инструментального исследования необходимо обращать особое внимание на проявление диабетической микроангиопатии (артериальная гипертензия, диабетической невро- и ретинопатии).
- Противопоказанием для планирования беременности является (приказ МЗ РФ № 302 от 28.12.93 г.):
- диабет у обоих супругов;
- наличие инсулинорезистентности и лабильных форм сахарного диабета;
- сочетание сахарного диабета и активной формы туберкулеза;
- сочетание сахарного диабета и резус-сенсибилизации матери в анамнезе, смерть или рождение детей с аномалиями развития при условии хорошо компенсированного во время беременности сахарного диабета;
- прогрессирующие сосудистые осложнения сахарного диабета (свежие кровоизлияния в сетчатку глаза, диабетическая нефропатия с проявлениями почечной недостаточности и артериальной гипертензии).
- В случае наступления незапланированной беременности у женщин с сахарным диабетом не рекомендуется ее пролонгировать, если:
- возраст больше 38 лет;
- уровень гликозилированного гемоглобина в ранний период беременности более 12 %;
- кетоацидоз развивается на ранних сроках беременности.
Ведение беременных с сахарным диабетом
Общие рекомендации. Прежде всего необходимо совместное ведение беременной акушером-гинекологом и эндокринологом, обучение ее самостоятельному контролю уровня глюкозы в крови и подбору дозы инсулина. Женщина должна соблюдать режим физической активности и избегать физических и эмоциональных перегрузок. Умеренная ежедневная нагрузка способствует снижению уровня глюкозы плазмы и потребности в инсулине, в то время как резкие изменения физической активности могут привести к декомпенсации сахарного диабета.
В первой половине беременности больная должна посещать врача женской консультации и эндокринолога 1 раз в 2 недели, во второй половине—еженедельно. УЗИ проводят в сроки 15— 20 нед (для исключения грубых пороков развития), 20—23 нед (для исключения пороков сердца), 28— 32 нед (для раннего выявления макросомии, ЗВУР плода, оценки объема околоплодных вод) и перед родами — для исключения макросомии плода и решения вопроса о тактике ведения родов.
На сроке 15—20 нед определяют уровень АФП в сыворотке. Периодически определяют уровень гликозилированного гемоглобина, а в III триместре беременности повторно проводят офтальмоскопию для решения вопроса о возможности физиологического ведения родов.
При сахарном диабете необходимо придерживаться специально разработанной диеты. Калорийность суточного рациона определяют из расчета 30—35 ккал/кг идеальной массы тела. В среднем она составляет 1800—2400 ккал; 40—45 % калорийности рациона должно приходиться на углеводы, 20—30 % —на белки и 30 % — на жиры. Необходимо исключить легкоусвояемые углеводы. Пищу принимают 5—6 раз в день с интервалами 2—3 ч (завтрак, обед, ужин и 2—3 дополнительных приема пищи между ними). При этом больные с сахарным диабетом II типа должны строго придерживаться низкокалорийной диеты и стараться, чтобы прибавка массы тела не превышала 10 кг, а при наличии ожирения — 7 кг.
Гестационный сахарный диабет. Единственным надежным методом диагностики гестационного сахарного диабета является часовой пероральный глюкозотолерантный тест с 50 г глюкозы, который необходимо проводить всем женщинам в 24—28 нед беременности. При наличии факторов риска по развитию диабета тест проводят при первом посещении врача, а далее повторяют в 24—28 нед.
Часовой пероральный глюкозотолерантный тест заключается в определении уровня глюкозы плазмы через 1 ч после приема 50 г глюкозы внутрь. Тест можно проводить натощак. При уровне глюкозы плазмы ниже 7,8 ммоль/л обследование и лечение не требуются. При уровне глюкозы от 7,8 до 10,6 ммоль/л показано проведение трехчасового теста со 100 г глюкозы. При уровне глюкозы плазмы выше 10,6 ммоль/л устанавливают предварительный диагноз диабета беременных.
При отклонении от нормы результатов одночасового теста с 50 г глюкозы проводят трехчасовой тест со 100 г глюкозы. Отклонение от нормы двух или трех показателей трехчасового теста свидетельствует о диабете беременных (табл. 4). При сахарном диабете II типа уровень глюкозы натощак обычно в норме, а при сахарном диабете I типа — повышен.
Таблица 4. Результаты трехчасового перорального глюкозотолерантного теста при диабете беременных (моль/л)
| Материал для исследования | Натощак | Через 1 ч после приема глюкозы | Через 2 ч после приема глюкозы | Через 3 ч после приема глюкозы |
| Плазма | 5,8 | 10,6 | 9,2 | 8,1 |
| Цельная кровь | 5,0 | 9,2 | 8,1 | 6,9 |
Если результаты трехчасового теста в норме, повторное исследование показано на сроке 32— 34 нед при наличии одного из следующих факторов риска:
- диабет беременных в анамнезе;
- ожирение беременной;
- возраст беременной старше 35 лет;
- прием лекарственных средств, вызывающих гипергликемию;
- многоводие или макросомия плода.
При наличии факторов риска диабета беременных и отрицательном результате теста на сроке беременности менее 30 нед его повторяют каждые 4 нед.
Пациенткам с диагностированным гестационным сахарным диабетом в течение 2 нед проводится диетотерапия с последующим определением уровня глюкозы в крови натощак и трижды с интервалом в 1 ч после приема пищи. В случае нормы — уровень глюкозы продолжают определять каждые 2 нед. При превышении нормы одного из показателей начинают инсулинотерапию.
Наличие гестационного диабета не требует каких-либо особых мероприятий по проведению родоразрешения. После рождения малыша мать не нуждается в инсулине, но гликемию необходимо контролировать до выписки и в течение 6 нед должен быть проведен полный тест на толерантность к глюкозе.
Пациентки с результатами теста, типичным для сахарного диабета, переводятся под наблюдение эндокринолога. Пациентки с нормальной толерантностью к глюкозе должны быть проинформированы о важности поддержания идеальной массы тела с помощью диеты и физических нагрузок. В любой последующей беременности они должны сразу встать на учет и пройти пероральный глюкозотолерантный тест. Если результат будет в пределах нормы, то тест необходимо будет повторить на 28-й неделе беременности.
Сахарный диабет I и II типа. Алгоритм профилактики фетопатий и перинатальной смертности у беременных с сахарным диабетом следующий.
- Все женщины с прегестационным сахарным диабетом, планирующие беременность, за 5— 6 мес до зачатия должны быть направлены к эндокринологу для уточнения степени компенсации сахарного диабета, уточнения наличия и выраженности поздних осложнений диабета, проведения обучения методам самоконтроля в Школе диабета и для решения вопроса о возможности вынашивания беременности.
- При диагностировании беременности женщина должна быть неоднократно госпитализирована.
Первая госпитализация — на ранних стадиях беременности (желательно в 4—6 нед беременности). Цель госпитализации:
- полное клиническое обследование;
- коррекция доз инсулина, выбор тактики лечения;
- обучение женщины в Школе диабета;
- уточнение наличия и выраженности поздних осложнений диабета;
- решение вопроса о возможности вынашивания беременности;
- выявление и лечение акушерской патологии, исследования состояния фетоплацентарного комплекса;
- консультация генетика.
Вторая госпитализация — в 12—14 нед, когда понижается потребность в инсулине и возрастает частота гипогликемических состояний.
Третья госпитализация — на 23—24-й неделе беременности. Цель госпитализации:
- коррекция доз инсулина;
- контроль течения диабетических микроангиопатий;
- выявление и лечение появившихся осложнений беременности (угрожающее прерывание беременности, многоводие, урогенитальные инфекции) и сопутствующей патологии;
- оценка состояния фетоплацентарного комплекса;
- проведение курса профилактической терапии.
Четвертая госпитализация — на 30—32-й неделе беременности с целью:
- коррекции инсулинотерапии;
- контроль за течением осложнений диабета;
- оценки состояния фетоплацентарного комплекса с помощью функциональных методов исследования: фето- и плацентометрии, допплерографии, КТГ;
- оценки гормонального, иммунологического и гемостазиологического статуса;
- проведения профилактики развития болезни гиалиновых мембран легких плода;
- подготовки к родоразрешению;
- выбора срока и метода родоразрешения.
Срок родоразрешения у беременных с сахарным диабетом определяют индивидуально, с учетом тяжести течения болезни, степени его компенсации, функционального состояния плода и наличия акушерских осложнений. При планировании родов у больных с сахарным диабетом I типа необходимо проводить оценку степени зрелости плода, так как возможно запоздалое созревание его функциональных систем. Однако нарастание различных осложнений к концу беременности (ФПН, поздний гестоз и др.) диктует необходимость родоразрешения больных в 37— 38 нед. Учитывая возможность макросомии, если в 38 нед беременности масса плода превышала 3900 г, следует индуцировать роды. При массе плода 2500—3800 г беременность пролонгируют.
Оптимальным методом родоразрешения для матерей, больных сахарным диабетом, и их плодов, считают роды через естественные родовые пути, которые проводят под постоянным контролем уровня гликемии (каждые 2 ч), тщательным обезболиванием, терапией ФПН и адекватной инсулинотерапией.
Учитывая характерные для сахарного диабета особенности родового акта, необходимо проводить тщательную подготовку родовых путей. При подготовленных родовых путях родовозбуждение целесообразно начинать с амниотомии. При эффективной родовой деятельности роды продолжают вести через естественные родовые пути с широким применением спазмолитических средств.
Для предупреждения вторичной слабости родовых сил, слабости потуг и для обеспечения активной родовой деятельности к моменту рождения массивного плечевого пояса плода при раскрытии шейки матки 7—8 см необходимо начать внутривенное ведение окситоцина. На фоне проводимой терапии для профилактики декомпенсации сахарного диабета в родах через каждые 1— 2 ч необходимо определять у роженицы уровень гликемии.
Роды обязательно нужно вести под КТГ-контролем. В случае выявления гипоксии плода или вторичной слабости родовых сил принимают решение об оперативном родоразрешении (акушерские щипцы с предварительной эпизиотомией). При неподготовленных родовых путях, отсутствии эффекта от родовозбуждения или появлении симптомов нарастающей гипоксии плода роды также необходимо закончить оперативно. До настоящего времени абсолютных показаний к плановому оперативному родоразрешению при сахарном диабете не существует. Тем не менее можно выделить следующие показания (кроме общепринятых в акушерстве):
- выраженные или прогрессирующие осложнения диабета и беременности;
- тазовое предлежание плода;
- наличие крупного плода;
- прогрессирующая гипоксия плода при отсутствии условий для срочного родоразрешения через естественные родовые пути и при сроке беременности не менее 36 нед.
Хорошая компенсация диабета позволяет предотвратить развитие осложнений как у матери, так и у плода. Поддержание уровня глюкозы обеспечивается благодаря применению человеческого инсулина. Цель инсулинотерапии — максимально приблизить обмен глюкозы к нормальному, не допуская гипергликемии, кетоацидоза и тяжелой гипогликемии. Начальную дозу инсулина рассчитывают с учетом массы тела женщины и срока беременности. Начальная доза инсулина в I триместре беременности должна быть равна 0,6 ЕД/кг, во II триместре — 0,7 ЕД/кг и в III триместре — 0,8 ЕД/кг. Для беременных с низкой массой тела начальная суточная доза инсулина должна быть равна 0,4; 0,5 и 0,6 ЕД/кг соответственно. Обычно 2/3 общей суточной дозы инсулина вводят перед завтраком, 1/3 — перед ужином. Примерно треть утренней дозы приходится на инсулин короткого действия, 2/3 — на инсулин средней длительности действия.
Лечение в родах проводят дробными дозами инсулина под контролем гликемии (поддерживая ее на уровне 6,6—8,8 ммоль/л), корригируя ее уровень также 5 % раствором глюкозы внутривенно для предотвращения гипогликемии. В день родов вводят простой инсулин в дозе, составляющей 1/4 суточной дозы, и далее под контролем гликемии производят внутривенно введение инсулина в дозе 2—3 ЕД/ч вместе с 100—150 мл 5 % раствора глюкозы. При оперативном родоразрешении накануне операции больные должны оставаться на ранее подобранной адекватной дозе инсулина. В день операции больную не кормят и ей не вводят инсулин. Во время операции при гликемии менее 8 ммоль/л инсулин не вводят; при гликемии более 8 ммоль/л коррекцию гликемии производят простым инсулином короткого действия. На 4—5-е сутки после операции больную переводят на препараты пролонгированного действия. После родов дозу инсулина уменьшают в 2—3 раза.
* * *
В заключение необходимо подчеркнуть, что беременность на фоне сахарного диабета расценивается как ситуация повышенного риска, требующая квалифицированного подхода и тщательного наблюдения, так как именно от грамотного ведения беременности и родов зависит здоровье и жизнь не только матери, но и ребенка.
Заболевания щитовидной железы и беременность
Анатомия и физиология щитовидной железы
Щитовидная железа представляет собой небольшой орган массой 15—20 г, имеет форму бабочки и располагается на шее спереди от трахеи и снизу от гортани. Она состоит из двух долей размером до 4 см в длину и 2,5 см в ширину, соединенных перешейком. Нередко у молодых и худых людей щитовидную железу можно увидеть. Прощупывается она у большинства людей, за исключением лиц с развитой шейной мускулатурой и клетчаткой.
Функциональной единицей щитовидной железы является фолликул, состоящий из сферической массы клеток, окружающих неклеточную центральную часть, образованную белковым коллоидом. Между фолликулами диффузно расположены парафолликулярные клетки, или С-клетки, продуцирующие кальцитонин, который участвует в регуляции уровня кальция в организме.
Из фолликулов в кровь выделяются тиреоидные гормоны — тироксин (Т4) и трийодтиронин (Т3). Последние получили свои названия по количеству атомов йода в их молекулах. Тироксин, являясь основным продуктом деятельности щитовидной железы, не является при этом активной формой гормона. Более высокое сродство ядерных рецепторов к трийодтиронину делает его более сильным гормоном, при этом только 15 % его поступает в кровоток из щитовидной железы. Большая часть циркулирующего Т3 образуется в результате периферического дейодирования Т4. Ферментные системы печени, почек и других тканей контролируют продукцию активного тироксина путем перевода его в реверсные неактивные Т3 и Т2. В крови большая часть тиреоидных гормонов находится в связи с белком-переносчиком — тиреоидсвязывающим глобулином — и неактивна, в то время лишь небольшая свободная фракция гормонов активна и выполняет свои функции.
Функция щитовидной железы находится под контролем гипоталамо-гипофизарной системы. В гипоталамусе синтезируется тиреотропин-рилизинг гормон. Этот гормон, попадая в гипофиз, стимулирует образование ТТГ, который в свою очередь стимулирует деятельность щитовидной железы и образование Т4 и Т3.
Гормоны щитовидной железы участвуют практически во всех процессах организма, регулируя обмен веществ, синтез витаминов (витамина А в печени), а также принимают участие в осуществлении функции других гормонов в организме. Например, без гормонов щитовидной железы невозможно воздействие гормона роста на головной мозг. Доказанной является роль щитовидной железы в нормальном развитии молочных желез и в функционировании иммунной и репродуктивной систем. Предполагается, что изменение функции щитовидной железы играет важную роль в старении организма.
В настоящее время патология щитовидной железы является одной из самых распространенных в мире и по своей значимости находится на одном уровне с сахарным диабетом и заболеваниями сердечно-сосудистой системы.
Заболевания щитовидной железы, сопровождающиеся как снижением, так и повышением ее функции, часто выявляются у молодых женщин в детородном возрасте и могут влиять на течение и исход беременности, а также на состояние новорожденного. Однако при своевременном выявлении и коррекции практически любая патология щитовидной железы не является противопоказанием к планированию и пролонгированию беременности.
Таблица 5. Распространенность тиреоидной патологии среди беременных
| Патология | Распространенность, % |
| Гипотиреоз | 2 |
| Аутоиммунный тиреоидит | 25 |
| Эутиреоидный диффузный зоб | 24 |
| Узловой зоб | 4 |
Беременность редко развивается на фоне выраженной эндокринной патологии, поскольку она зачастую приводит к нарушению репродуктивной функции и бесплодию. Наиболее часто во время беременности диагностируется диффузное увеличение щитовидной железы (зоб) с сохранением эутиреоза и аутоиммунный тиреоидит, приводящий к изменениям гормонального фона в организме (табл. 5).
Эмбриология щитовидной железы плода
Закладка щитовидной железы у плода происходит на 3—4-й неделе эмбрионального развития из энтодермы, как выпячивание стенки глотки между 1-й и 2-й парами жаберных карманов. Примерно в это же время происходит закладка ЦНС (активно начинаются процессы дендритного и аксонального роста, синаптогенез, нейрональная миграция и миелинизация), которые не могут адекватно развиваться без достаточного количества тиреоидных гормонов. Щитовидная железа плода приобретает способность захватывать йод только с 10—12-й недели беременности, а синтезировать и секретировать тиреоидные гормоны начинает с 15-й недели. Примерно к этому же времени происходит созревание гипоталамо-гипофизарной системы и в крови у плода начинает определяться ТТГ. Таким образом, практически всю первую половину беременности щитовидная железа плода не функционирует, а его развитие в полной мере зависит от тиреоидных гормонов матери.
В норме плацента проницаема для тиреоидных гормонов, однако благодаря высокой активности дейодиназ уровень материнских гормонов в плодовом кровотоке значительно ниже, что предохраняет организм плода от токсического действия чрезмерных количеств Т4 и Т3. Материнский ТТГ не проходит через плаценту, но через нее легко проникает йод, тиреолиберин, иммуноглобулины (IgG) и тиреостатики. Примерно треть материнского тироксина проходит через плаценту к плоду и может влиять на его развитие, до того как начинается синтез собственных тиреоидных гормонов. И даже после начала самостоятельного синтеза гормонов во второй половине беременности материнские Т4 и Т3 продолжают проникать через плаценту и влиять на функционирование плодовых органов и систем.
В нормальных условиях при поступлении в организм выраженного количества йода происходит временная блокада синтеза гормонов щитовидной железы. Следует заметить, что данный эффект может развиться лишь при поступлении фармакологических доз йода, что возможно при длительном приеме ряда лекарственных препаратов (амиодарон) и введении йодсодержащих контрастных агентов. Способность к эффекту Вольфа—Чайкова появляется у плода примерно к 8-му месяцу беременности, что необходимо помнить при назначении беременным йодсодержащих лекарственных препаратов.
По мере увеличения срока беременности происходит изменение концентрации тиреоидных гормонов в плодовом кровотоке. Содержание Т4 прогрессивно увеличивается с середины беременности к моменту родов. Уровень трийодтиронина у плода достаточно низок до 20-й недели беременности, а затем к концу беременности значительно возрастает до 60 нг/мл. Уровень ТТГ постепенно повышается и к моменту родов составляет около 10 мкЕД/мл.
В первые минуты при рождении у ребенка имеет место значительный выброс ТТГ, пик которого достигается к 30-й минуте. Затем постепенно наблюдается снижение уровня ТТГ, которое достигает нормальных значений к концу 2—3-го дня. Острое повышение уровня ТТГ влечет за собой значительное возрастание уровней тироксина и трийодтиронина в течение первых часов жизни ребенка, что способствует его адаптации к условиям внеутробного существования.
Оценка функции щитовидной железы во время беременности
На фоне беременности происходит изменение функционирования щитовидной железы, что необходимо учитывать при оценке ее деятельности. В связи с этим для правильной интерпретации лабораторных показателей, отражающих деятельность щитовидной железы, врач должен помнить, что:
- необходимо сочетанное определение уровня ТТГ и свободного Т4;
- определение общего Т4 и Т3 не информативно, так как во время беременности их уровни всегда повышены в 1,5 раза;
- количество ТТГ в первой половине беременности в норме снижено у 20—30 % женщин при одноплодной и у 100 % при многоплодной беременности;
- уровень свободного Т4 в I триместре несколько повышен примерно у 2 % беременных и у 10 % женщин с подавленным ТТГ;
- уровень свободного Т4, определяемый на поздних сроках беременности, бывает погранично снижен при нормальном количестве ТТГ;
- для мониторинга терапии патологии щитовидной железы используют сочетанное определение уровня свободного Т4 и ТТГ, а в случае лечения у беременной тиреотоксикоза — одного только уровня свободного Т4.
Как указывалось выше, определение уровня общих тиреоидных гормонов для оценки функции щитовидной железы во время беременности не информативно, поскольку он всегда будет повышен. Уровень свободного Т4 в I триместре беременности, как правило, высоконормален, но примерно у 10 % женщин с подавленным ТТГ превышает верхнюю границу нормы. Уровень свободного Т3 меняется однонаправленно с уровнем свободного Т4, но повышенным оказывается реже. Ситуация физиологического подавления уровня ТТГ в сочетании с повышением уровня свободного Т4 иногда обозначается как транзиторный гестационный гипертиреоз.
По мере увеличения срока беременности уровень свободного Т4 постепенно снижается и к концу беременности часто оказывается низконормальным. Физиологическое снижение уровня свободного Т4 связано со значительным увеличением тироксинсвязывающей активности плазмы к концу беременности.
Среди антител к щитовидной железе для диагностики ее аутоиммунной патологии целесообразно исследовать только антитела к тиреоидной пероксидазе, поскольку изолированное носительство антител к тиреоглобулину встречается редко и имеет меньшее диагностическое значение. Носительство антител к тиреоидной пероксидазе — распространенный феномен в популяции, далеко не всегда имеющий патологическое значение, однако у женщин-носительниц этих антител в 50 % случаев развивается послеродовый тиреоидит.
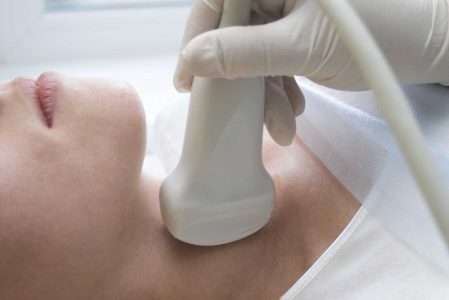
Для оценки функционального состояния щитовидной железы во время беременности, кроме гормонального исследования, могут быть использованы УЗИ и тонкоигольная аспирационная биопсия. Сцинтиграфия и радионуклидное исследование во время беременности запрещены.
Ультразвуковое исследование позволяет точно определить объем щитовидной железы (в норме у женщин он менее 18 мл) и отслеживать его динамику на фоне проводимой терапии. Кроме того, УЗИ позволяет точно определить размер узловых образований и оценить эхоструктуру щитовидной железы. В норме на фоне беременности происходит постепенное увеличение объема железы, связанное с ее гиперстимуляцией. При отсутствии патологии во время беременности объем щитовидной железы увеличивается, но редко превышает 18 мл, а в течение года после родов возвращается к исходным значениям.
Проведение пункционной биопсии показано для дифференциальной диагностики узлового зоба при обнаружении в щитовидной железе пальпируемых и/или превышающих 1 см в диаметре (по данным УЗИ) узловых образований. Оптимальным сроком проведения данной процедуры является II триместр беременности. Тонкоигольная аспирационная биопсия безопасна для женщины и плода и не повышает риска развития осложнений беременности.
Йоддефицитные заболевания и беременность
Йоддефицитными заболеваниями, по определению ВОЗ, обозначаются все патологические состояния, развивающиеся в популяции вследствие йодного дефицита, которые могут быть предотвращены при нормализации потребления йода. По данным ВОЗ, 30 % населения мира имеют йоддефицитные заболевания, а более 1 млрд. людей проживает в районах с йодным дефицитом, к которым относятся практически вся территория России и континентальной Европы, Центральные районы Африки и Южной Америки. Йод является необходимым компонентом тиреоидных гормонов. В норме в организме содержится до 20—30 мг йода, при этом основное его количество сконцентрировано в щитовидной железе. Для достижения указанного количества в организм должно поступать ежедневно для взрослого человека 150 мкг йода, для беременных и кормящих — 200 мкг. По данным ряда авторов, поступление йода в организм за сутки в России не превышает 40—80 мкг, что примерно в 2—3 раза меньше суточной потребности. Недостаточность поступления йода в организм приводит к развертыванию цепи последовательных приспособительных процессов, направленных на поддержание нормального синтеза и секреции гормонов щитовидной железы. Но если дефицит этих гормонов сохраняется достаточно долго, то происходит срыв механизмов адаптации с последующим развитием йоддефицитных заболеваний.
Беременность является наиболее мощным фактором, потенцирующим влияние дефицита йода на организм как матери, так и плода. Все перечисленные выше механизмы стимуляции щитовидной железы во время беременности носят физиологический характер, обеспечивая адаптацию эндокринной системы женщины к беременности. Снижение поступления йода во время беременности (и даже перед ней) приводит к хронической стимуляции железы, относительной гипотироксинемии и формированию зоба как у матери, так и у плода. Очень важно отметить, что термин «относительная гестационная гипотироксинемия» на сегодняшний день не имеет конкретных диагностических критериев. Под относительной гестационной гипотироксинемией подразумевают феномен, при котором уровень свободного Т4 у беременной не достигает должного для этого физиологического состояния, но при этом сохраняется в пределах нормы для здоровых небеременных женщин. Расценить это как признаки легкой гипотироксинемии позволяют следующие факты: во-первых, именно у женщин с низким уровнем тироксина чаще рождаются дети с легкими психомоторными нарушениями; во-вторых, именно у этих женщин имеется высокий индекс осложнений беременности, характерных для гипотиреоидных больных (спонтанные аборты, преждевременные роды, перинатальная смертность, врожденные пороки развития, осложнения в родах). В тех случаях, когда увеличение размеров щитовидной железы не нормализует тиреоидный статус, включается еще один компенсаторный механизм — синтез более активного тироксина, который нормализует уровень ТТГ.
Как уже указывалось, в первой половине беременности уровень свободного Т4 должен увеличиться на 30—50 %. В ситуации, когда женщина проживает в условиях йодного дефицита, ее щитовидная железа еще до беременности функционирует, в той или иной степени затрачивая свои резервные возможности. В результате гиперстимуляция железы не дает должного результата, а приобретает патологическое значение, приводя к формированию у беременной зоба, причем вероятность формирования его коррелирует с выраженностью йодного дефицита. Ряд исследователей показали, что объем щитовидной железы у женщин, проживающих в условиях легкого йодного дефицита, к концу беременности увеличивается на 20—40 %, у 20 % из них в дальнейшем развивается зоб.
Наиболее явным проявлением йодного дефицита и недостаточного поступления йода в организм является диффузный эутиреоидный (нетоксический) зоб — диффузное увеличение щитовидной железы без нарушения ее функции. Для обозначения зоба, вызванного йодным дефицитом, используется также термин «эндемический зоб». Увеличение щитовидной железы при йодном дефиците является компенсаторной реакцией для обеспечения синтеза достаточного количества тиреоидных гормонов. Вторым наиболее частым проявлением йодного дефицита у взрослых является развитие узлового зоба. Обычно в начале узловой зоб не проявляется изменением функции щитовидной железы. Тем не менее в условиях резкого увеличения поступления йода в организм (например, при приеме некоторых йодсодержащих препаратов) это может привести к развитию йодиндуцированного тиреотоксикоза. Кроме того, в условиях йодного дефицита клетки щитовидной железы могут приобретать частичную или полную автономию от регулирующего влияния ТТГ, что приводит к формированию функциональной автономии в железе, а в дальнейшем к развитию тиреотоксикоза. Обычно автономные узлы в щитовидной железе и йодиндуцированный тиреотоксикоз встречаются у людей в возрасте старше 50—55 лет. При крайней степени йодного дефицита может развиться гипотиреоз, обусловленный выраженной нехваткой в организме тиреоидных гормонов.
Дефицит йода, помимо увеличения щитовидной железы, приводит к ряду других патологических состояний. Спектр йоддефицитных заболеваний широк и зависит от того, в каком периоде жизни имеется воздействие недостатка йода на организм (табл. 6). Наличие недостатка йода в период беременности и эмбрионального развития способствует высокой частоте спонтанных абортов, особенно в I триместре, высокой перинатальной и детской смертности, врожденным порокам развития, врожденному гипотиреозу с отставанием физического и умственного развития. В зрелом возрасте дефицит йода обусловливает различной степени увеличение щитовидной железы, снижение физической и умственной работоспособности, симптомы субклинического и клинического гипотиреоза, нарушение менструального цикла и репродуктивной функции (бесплодие, невынашивание беременности, преждевременные роды). Особенно опасен йодный дефицит во время беременности, когда недостаточное поступление йода в организм усугубляется возрастающими потребностями в нем со стороны щитовидной железы матери и плода. В таких условиях высок риск развития выкидышей, врожденных аномалий плода, а у родившихся детей — гипотиреоза и умственной отсталости.
Дефицит йода обусловливает снижение интеллектуального уровня всей популяции, проживающей в условиях йодной недостаточности. Показатели умственного развития населения в регионах йодной недостаточности на 10—15 % ниже таковых в регионах без дефицита йода. Причиной этого является неблагоприятное воздействие даже умеренного йодного дефицита в период формирования ЦНС.
В эмбриональном периоде развития тиреоидные гормоны обеспечивают процессы нейрогенеза, миграции нейронов, дифференцировку улитки, т. е. формируется слух и те церебральные структуры, которые отвечают за моторные функции человека. В регионах с выраженным дефицитом йода преобладает неврологический кретинизм, характеризующийся, помимо значительного дефекта интеллектуального развития, нейросенсорной (перцептивной) глухотой, немотой и тяжелыми моторными нарушениями.
Таблица 6. Спектр йоддефицитной патологии (ВОЗ, 2001)
| Период | Патология | |
| Внутриутробный период | Аборты | |
| Мертворождение | ||
| Врожденные аномалии | ||
| Повышение перинатальной | ||
| смертности | ||
| Неврологический кретинизм: | ||
| умственная отсталость | ||
| глухонемота | ||
| косоглазие | ||
| Микседематозный кретинизм (гипотиреоз, карликовость): | ||
| умственная отсталость | ||
| низкорослость | ||
| гипотиреоз | ||
| Психомоторные нарушения | ||
| Новорожденные | Неонатальный гипотиреоз | |
| Дети и подростки | Нарушение умственного и физического развития | |
| Взрослые | Зоб и его осложнения | |
| Йодиндуцированный тиреотоксикоз | ||
| Все возрасты | Зоб | |
| Гипотиреоз | ||
| Нарушение когнитивных функций |
Менее выраженный дефицит гормонов в этом периоде приводит к развитию более легких психомоторных нарушений, тугоухости и дизартрии (неврологический субкретинизм). Легкий дефицит тиреоидных гормонов, не вызывая серьезных ментальных нарушений, все же может помешать реализации генетического уровня интеллектуальных возможностей ребенка.
Диагностика. Недостаточность поступления йода в организм диагностируют с помощью различных методов исследования, среди которых наиболее информативным является определение йодурии. Определение содержания ТТГ и тиреоглобулина в сыворотке крови, а также УЗИ щитовидной железы помогают объективно оценить степень выраженности патологии.
Функциональное состояние щитовидной железы оценивают по уровню свободного Т4, Т3 и ТТГ в сыворотке.
Профилактика йоддефицитных заболеваний во время беременности. Для восполнения дефицита йода используют различные варианты йодной профилактики. Наиболее эффективным методом, рекомендованным ВОЗ, является массовая йодная профилактика, которая заключается в использовании йодированной пищевой соли. Поскольку беременность является периодом наибольшего риска формирования тяжелых йоддефицитных заболеваний, уже на этапе ее планирования женщинам целесообразно назначать индивидуальную йодную профилактику физиологическими дозами йода — 200 мкг в день в виде точно дозированных лекарственных препаратов (йодомарин, йодид 100/200) или минерально-поливитаминных комплексов для беременных. Йодную профилактику целесообразно проводить на протяжении всего периода беременности и грудного вскармливания. Единственным противопоказанием для проведения йодной профилактики является диффузный токсический зоб (болезнь Грейвса).
Лечение эутиреоидного зоба во время беременности. Наличие у пациентки эутиреоидного зоба не является противопоказанием для планирования беременности. Исключение составляют крайне редкие случаи гигантского зоба с явлениями компрессии. Основным условием для планирования беременности является надежное поддержание эутиреоза, которое при необходимости может быть обеспечено назначением L-тироксина (эутирокс). Лечение узлового зоба вне беременности обычно преследует две цели: уменьшение размеров узла и устранение клинических симптомов при наличии гиперфункции железы. Однако во время беременности нет необходимости добиваться кардинального регресса зоба. Как минимум, это связано с тем, что срок беременности ограничен и за такой короткий промежуток времени существенного уменьшения объема щитовидной железы достичь трудно. Кроме того, даже при достаточном поступлении йода во время беременности отмечается некоторое увеличение объема щитовидной железы. Перед началом лечения пациентам, имеющим узловые образования, превышающие в диаметре 1 см, проводят тонкоигольную аспирационную биопсию узла. Если на основании цитологического исследования установлен диагноз фолликулярной аденомы щитовидной железы или имеется подозрение на злокачественное новообразование — показано оперативное лечение. Консервативное лечение возможно только при обнаружении узлового коллоидного зоба, не превышающего в диаметре 3 см. Чаще всего выявляются именно такие узловые образования. Развитие узлового коллоидного зоба так же, как и диффузного эутиреоидного зоба, во многом связано с хроническим дефицитом йода в организме. Перед началом лечения обязательно проводят предварительное гормональное исследование. Лечение эутиреоидного зоба включает использование трех вариантов терапии.
- Монотерапия препаратами йода.
- Монотерапия препаратами L-тироксина.
- Комбинированная терапия препаратами йода и L-тироксина.
Оптимальным следует признать первый вариант терапии (монотерапия препаратами йода).
Этого бывает достаточно для нормализации гормоногенеза в щитовидной железе. Если женщина получала до беременности комбинированную терапию препаратами йода и L-тироксина, то не стоит ее переводить на монотерапию йодом. При нормальной функции железы и небольшом ее увеличении дополнительное назначение супрессивной терапии L-тироксином (100— 150 мкг в день) впервые во время беременности не целесообразно, хотя безопасно как для матери, так и для плода. С целью описанной комбинированной терапии удобно использовать препараты, содержащие в составе оба компонента, например йодтирокс, содержащий эутирокс и йод. Если до беременности женщине была назначена монотерапия L-тироксином, то в целях проведения индивидуальной йодной профилактики, целесообразно переводить пациентку на комбинированную терапию с добавлением 200 мкг йода в сутки.
Как уже было отмечено, в условиях йодного дефицита клетки щитовидной железы довольно часто приобретают способность автономно функционировать, т. е. не зависеть от уровня ТТТ. В таком случае назначение препаратов йода может вызвать развитие йодиндуцированного тиреотоксикоза. В связи с этим назначение препаратов йода противопоказано пациенткам с повышенной функцией щитовидной железы, при наличии узлового зоба в сочетании с признаками автономии в узле (повышенное накопление радиоактивного йода при сканировании щитовидной железы до беременности, уменьшенный уровень ТТГ).
Необходимо предупредить пациентку, что терапия эутиреоидного зоба длительна и проводится не менее 6 мес с последующим контрольным обследованием и оценкой функции щитовидной железы.
Узловой зоб и беременность
Распространенность узловых образований щитовидной железы среди беременных женщин составляет 4 %, в данном случае речь идет только о пальпируемых узлах и/или превышающих в диаметре 1 см по данным УЗИ. В подавляющем большинстве случаев выявляется узловой коллоидный пролиферирующий зоб, который не является опухолевым заболеванием щитовидной железы и, как правило, не требует оперативного лечения. Данное заболевание не является противопоказанием для планирования беременности, если узлы не превышают в диаметре 4 см с компрессионным синдромом. Если же коллоидный пролиферирующий зоб впервые выявлен у беременной и размеры его достигают 4 см, но не вызывают компрессию трахеи — оперативное лечение откладывается на послеродовой период.
Как и вне беременности, при выявлении превышающего 1 см в диаметре узлового образования показано проведение тонкоигольной аспирационной биопсии. Ультразвуковой контроль значительно повышает информативность метода, особенно когда речь идет о кистозных узловых образованиях. Если узловое образование выявлено во второй половине беременности, то тонкоигольная аспирационная биопсия может быть перенесена на послеродовой период во избежание стресса для пациентки. Перенос исследования на 2—4 мес не сопровождается повышением риска.
На фоне беременности риск увеличения размеров узлового и многоузлового коллоидного зоба не так велик. Поскольку в подавляющем большинстве случаев функция щитовидной железы при данной патологии не нарушена, пациенткам во время беременности показано проведение индивидуальной йодной профилактики физиологическими дозами йода. В любом случае показан контроль функции щитовидной железы с определением уровня ТТГ и свободного Т4 в каждом триместре беременности.
Гипотиреоз и беременность
Гипотиреоз — клинический синдром, обусловленный гипофункцией щитовидной железы и характеризующийся сниженным содержанием тиреоидных гормонов в сыворотке крови. Состояния, для которых характерно снижение секреции гормонов вне зависимости от конкретной причины, вызвавшей уменьшение ее функциональной активности, принято называть первичным гипотиреозом. В 99 % случаев причиной гипотиреоза является поражение самой щитовидной железы, в 1 % — поражение гипофиза или гипоталамуса (вторичный гипотиреоз). Среди причин первичного гипотиреоза выделяют:
- аномалии развития щитовидной железы (ее дисгенез и эктопия);
- йоддефицитные заболевания;
- тиреоидиты (аутоиммунный, послеродовый);
- тиреоидэктомию;
- терапию радиоактивным йодом и облучение железы;
- врожденный гипотиреоз;
- длительный прием избытка йода (амиодарон);
- опухоли и рак щитовидной железы.
Гипотиреоз является достаточно распространенной патологией и встречается у 19 из 1000 женщин. Несмотря на такую распространенность, гипотиреоз часто длительное время не выявляется. Это отчасти обусловлено тем, что заболевание имеет постепенное начало и стертые, неспецифические симптомы, которые расцениваются вначале как результат переутомления, других заболеваний, беременности. Распространенность гипотиреоза среди беременных составляет 2 %. Гипотиреоз при беременности встречается относительно редко, отчасти потому, что при явном нелеченом гипотиреозе у женщин часто развивается бесплодие.
Клинически синдром гипотиреоза проявляется такими признаками, как общая слабость, снижение работоспособности, судорожные сокращения мышц, боль в суставах, сонливость, депрессия, забывчивость, снижение внимания и интеллекта, повышение массы тела, брадикардия и уменьшение частоты дыхания, сухость кожных покровов, выпадение волос, грубый голос, тошнота, запоры, аменорея и отек кожи. При гипотиреозе в организме замедляются все процессы. В условиях недостатка тиреоидных гормонов энергия образуется с меньшей интенсивностью, что приводит к постоянной зябкости и понижению температуры тела. Другим признаком гипотиреоза может быть склонность к частым инфекциям, что обусловлено отсутствием стимулирующего влияния тиреоидных гормонов на иммунную систему. Одним из основных симптомов гипотиреоза является постоянная слабость и чувство усталости, даже по утрам. Пациентов беспокоят постоянные головные боли, часто — боли в мышцах и суставах. Онемение в руках обусловлено сдавлением нервов отечными тканями в канале запястья. Кожа становится отечной, сухой, волосы и ногти больных — ломкими. Наряду с физической заторможенностью у больных наблюдается и умственная заторможенность, и частая забывчивость. При гипотиреозе из-за отека тканей поражаются и органы чувств. Больных беспокоят расстройства зрения, снижение слуха, звон в ушах. Голос из-за отека голосовых связок становится низким; часто во сне пациенты начинают храпеть из-за отека языка и гортани. Замедление пищеварительных процессов приводит к запорам. Одним из самых серьезных признаков гипотиреоза является поражение сердца. У многих больных наблюдается замедление ритма сердца — менее 60 уд/мин. К другим сердечно-сосудистым проявлениям гипотиреоза относится повышение уровня холестерина в крови, что может привести к развитию атеросклероза сосудов сердца, ишемической болезни и перемежающейся хромоте. У большинства женщин наблюдается расстройство менструальной функции. Менструации могут стать обильнее, длительнее или прекратиться совсем. Многие женщины (до 25 %) при гипотиреозе впервые обращаются к гинекологу с жалобой на бесплодие, которое обусловлено неполноценной лютеиновой фазой цикла и ановуляцией. Кроме того, у таких пациенток часто развивается синдром галактореи-аменореи.
Гипотиреоз беременной наиболее опасен для развития плода и в первую очередь для развития его ЦНС. Причем заболевание матери оказывает более неблагоприятное воздействие на формирование и функционирование центральных структур мозга плода, чем гипотиреоз, обусловленный нарушением закладки самой щитовидной железы плода. Это объясняется тем, что в первую половину беременности щитовидная железа плода практически не функционирует и в норме развитие нервной системы происходит под воздействием материнских гормонов. Во второй половине беременности, в ситуации врожденного гипотиреоза будет интенсифицироваться трансплацентарный перенос материнского Т4, который компенсирует недостаток тиреоидных гормонов у плода. После родов вовремя выявленный врожденный гипотиреоз легко подвергается коррекции при помощи заместительной терапии, а учитывая, что процессы миелинизации в головном мозге происходят еще в течение года после рождения, нарушения умственной деятельности у детей развиваться не будет. Однако при материнском гипотиреозе формирование ЦНС плода с первых недель беременности будет проходить в условиях дефицита тиреоидных гормонов и носить необратимый характер (табл. 7).
В прошлом частота осложнений беременности и родов у женщин с гипотиреозом была достаточно высокой. На сегодняшний день они практически не встречаются при правильном и своевременном лечении гипотиреоза. При лабораторной диагностики гипотиреоза используют термины «манифестный» и «субклинический» гипотиреоз. Различия их заключаются в том, что под субклиническим гипотиреозом понимают изолированное повышение уровня ТТГ при нормальном уровне свободного Т4, под манифестным гипотиреозом — сочетание повышения уровня ТТГ и снижения уровня свободного Т4. Рядом исследователей было выявлено, что даже незначительное изменение уровня тиреоидных гормонов в крови при субклиническом течении болезни частота осложнений беременности значительна и несет выраженную угрозу не только здоровью женщины, но в первую очередь ее ребенку (табл. 8).
Таблица 7. Роль гормонов щитовидной железы в развитии головного мозга [Rovet J., 1999]
| Основные этапы развития головного мозга | Значение тиреоидных гормонов | Период жизни |
| Первичная нейрорегуляция | ?? | 3—4-я неделя |
| Развитие переднего мозга | ?? | 2—3-й месяц |
| Нейрональная пролиферация | +++ | 3—4-й месяц |
| Нейрональная миграция | +++ | 3—5-й месяц |
| Организация | +++ | 5-й месяц, годы постнатально |
| Миелинизация | +++ | Рождение, 1-й год постнатально |
Таблица 8. Частота (в процентах) осложнений беременности при гипотиреозе
| Осложнения беременности | Манифестный гипотиреоз | Субклинический гипотиреоз |
| Гипертензия, преэклампсия | 22 | 15 |
| Отслойка плаценты | 5 | 0 |
| Послеродовые кровотечения | 6,6 | 3,5 |
| Внутриутробная смерть плода | 6,6 | 1,7 |
| Пороки развития плода | 3,3 | 0 |
| Низкий вес при рождении | 16,6 | 8,7 |
Диагностика гипотиреоза. Наиболее чувствительным методом диагностики гипотиреоза является определение уровня ТТГ, так как было выявлено, что уровень ТТГ начинает выходить за рамки нормальных значений до того, как изменяется уровень тироксина. Повышенный уровень ТТГ указывает на пониженную активность щитовидной железы, и наоборот, низкий уровень ТТГ указывает на тиреотоксикоз. Таким образом, между уровнями гормонов щитовидной железы и ТТГ соблюдается принцип обратной связи: при снижении уровней тиреоидных гормонов повышается уровень ТТГ, и наоборот, при повышении уровней Т4 и Т3 снижается уровень ТТГ. Однако при интерпретации полученных данных необходимо помнить, что низкий уровень ТТГ может также наблюдаться при беременности, патологии гипофиза и других заболеваниях.
Нормальные значения уровней тиреоидных гормонов различаются в зависимости от метода проведения исследования, тем не менее в большинстве лабораторий они находятся в пределах для Т4 —50—160 нмоль/л, для Т3 — 1—2,9 нмоль/л, для ТТГ – 0,5-5,5 мМЕ/л.
Заместительная гормональная терапия гипотиреоза во время беременности. Компенсированный гипотиреоз не является противопоказанием для планирования беременности. Единственным методом лечения гипотиреоза является заместительная терапия тиреоидными гормонами. При беременности повышается потребность в L-тироксине и его доза должна быть увеличена. О необходимости этого женщина должна знать заранее. Вне беременности обычная заместительная терапия L-тироксином составляет 50—100 мкг/сут. Адекватной компенсации гипотиреоза соответствует поддержание уровня ТТГ в пределах 0,4— 2,0 мЕД/л. Если женщина с компенсированным гипотиреозом планирует беременность, дозу L-тироксина необходимо увеличить сразу после ее наступления на 50 мкг. В дальнейшем контроль адекватности терапии осуществляется по уровню ТТГ и свободного Т4, которые необходимо исследовать каждые 8—10 нед. Цель терапии — поддержание низконормального уровня ТТГ и высоконормального уровня свободного Т4. Если в I триместре беременности после увеличения дозы L-тироксина происходит некоторое подавление уровня ТТГ, дозу препарата уменьшать не следует, поскольку ТТГ и в норме в первой половине беременности снижен у 20 % женщин. Увеличение дозы L-тироксина на 50 мкг не несет никакого риска передозировки, но надежно предотвращает гипотироксинемию у плода. Обычно повторного увеличения дозы препарата не требуется, и вся беременность протекает на фоне приема 150—200 мкг/сут L-тироксина.
Однако у ряда пациенток после 20—22-й недели беременности возникает необходимость в увеличении дозы препарата на 25—50 мкг после гормонального исследования. L-тироксин принимают ежедневно утром за 30 мин до еды. Если у женщин имеет место выраженная рвота, то прием препарата следует сместить на более поздние часы. L-тироксин чаще всего выпускается в таблетках по 50 и 100 мкг (например, препарат эутирокс). В связи с тем что при гипотиреозе выработка гормонов щитовидной железой не восстанавливается, заместительная терапия является пожизненной.
При гипотиреозе, впервые выявленном во время беременности, пациенткам сразу назначают полную заместительную дозу L-тироксина без ее постепенного повышения, которое принято при терапии гипотиреоза вне беременности. Подходы к лечению манифестного и субклинического гипотиреоза во время беременности не отличаются. Если вне беременности вопрос о целесообразности заместительной терапии при субклиническом гипотиреозе остается дискуссионным, то во время беременности женщине однозначно показана заместительная терапия.
Аутоиммунный тиреоидит и беременность
Аутоиммунный тиреоидит (тиреоидит Хасимото) является основной причиной спонтанного гипотиреоза. Аутоиммунные (от лат. ауто — свой, сам) заболевания возникают при неспособности иммунной системы распознавать ткани собственного организма от «чужих», при этом в организме образуются аутоантитела к тканям щитовидной железы (антитела к тиреоидной пероксидазе и тиреоглобулину).
При аутоиммунном тиреоидите, когда щитовидная железа поражена аутоиммунным процессом, ее дополнительная физиологическая стимуляция, происходящая во время беременности, может не достичь своей цели и, как в ситуации с йодным дефицитом, у женщин не произойдет повышения продукции тиреоидных гормонов, которое необходимо для адекватного развития плода в первой половине беременности. Более того, гиперстимуляция измененной щитовидной железы при аутоиммунном тиреоидите может привести к манифестации гипотиреоза на фоне беременности. Однако не всякое повышение уровня антител к тиреоидной пероксидазе свидетельствует о наличии аутоиммунного тиреоидита и о существующем риске развития гипотироксинемии. В общей популяции на каждые 10—30 взрослых женщин приходится 1 случай заболевания аутоиммунным тиреоидитом. Если частота клинически явного аутоиммунного тиреоидита составляет 1—1,38 %, то наличие антител к пероксидазе выявляют в 10 % случаев у практически здоровых женщин.
Исследователями последних лет установлено, что аутоиммунные механизмы присущи не только хроническому аутоиммунному тиреоидиту, но и другим видам тиреоидитов, описываемых ранее как самостоятельное заболевание (табл. 9).
Таблица 9. Характеристика аутоиммунных тиреоидитов
| Тип тиреоидита | Длительность течения | Признаки тиреоидита |
| Тиреоидит Хасимото (гипертрофическая форма аутоиммунного тиреоидита) | Хроническое | Зоб, лимфатическая инфильтрация, гиперплазия тироцитов, деструкция фолликулов, склероз и фиброз |
| Идиопатический гипотиреоз (атрофическая форма аутоиммунного тиреоидита) | » | Атрофия щитовидной железы, склероз, фиброз |
| Безболезненный тиреоидит | Транзиторное | Умеренное увеличение щитовидной железы, лимфатическая инфильтрация |
| Послеродовой тиреоидит | Транзиторное, иногда прогрессирование в хронический тиреоидит | То же |
| Ювенильный тиреоидит | Хроническое | » » |
Диагностика. Диагностическими критериями, при выявлении сочетания которых беременной женщине целесообразно назначение превентивной заместительной терапии L-тироксином, является:
- повышение уровня антител к тиреоидной пероксидазе;
- увеличение уровня ТТГ на ранних сроках беременности более 2 мЕД/л;
- увеличение объема щитовидной железы более 18 мл по данным УЗИ.
Диагностика гипотиреоза во время беременности бывает затруднительной, так как и при нормальном ее течении женщины часто отмечают чувство холода, раздражительность или депрессию, выпадение волос. Для диагностики принципиальное значение имеют анализы крови на уровень ТТГ, тиреоидных гормонов, антител к щитовидной железе. В связи с тем что носительство антител к тиреоидной пероксидазе не имеет клинических проявлений, необходимо проводить скрининг на данную патологию до 12 нед беременности. При выявлении повышенного уровня антител к тиреоидной пероксидазе без других признаков аутоиммунного тиреоидита необходима динамическая оценка функции щитовидной железы во время беременности (в каждом триместре). Как указывалось выше, для ранних сроков беременности в норме характерен низкий уровень ТТГ. Если уровень ТТГ у носительниц антител к тиреоидной пероксидазе составляет 2 мЕД/л, назначение L-тироксина не показано, при ТТГ более 2 мЕД/л на ранних сроках беременности у женщин-носительниц этих антител косвенно свидетельствует о снижении функциональных резервов щитовидной железы и повышенном риске развития относительной гипотироксинемии, и для таких пациенток целесообразно рассматривать вопрос о назначении превентивной терапии L-тироксина. Если уровень ТТГ превышает 4 мЕД/л независимо от наличия или отсутствия антител, у пациентки с высокой вероятностью имеется гипотиреоз. Этим женщинам показана терапия L-тироксином на протяжении всей беременности, и она проводится по принципам, описанным выше. Многие работы демонстрируют, что у женщин, имеющих повышенный уровень антител к тиреоидной пероксидазе, даже без нарушений функции щитовидной железы, повышен риск спонтанного прерывания беременности на ранних сроках. Патогенез прерывания беременности на сегодняшний день остается невыясненным. Возможно, антитиреоидные антитела являются маркером генерализованной аутоиммунной дисфункции, в результате которой и происходит выкидыш.
Основные положения рекомендаций Российской ассоциации эндокринологов по диагностике аутоиммунного тиреоидита, утвержденные в 2002 г., заключаются в следующем.
- Диагноз аутоиммунного тиреоидита не может быть установлен только на основании данных пальпации щитовидной железы, а также после обнаружения увеличения или уменьшения ее объема.
- «Большими» диагностическими признаками, сочетание которых позволит установить диагноз аутоиммунного тиреоидита, являются:
- первичный гипотиреоз (манифестный или стойкий субклинический);
- наличие антител к ткани щитовидной железы или ультразвуковые признаки аутоиммунной патологии.
- При отсутствии хотя бы одного из «больших» диагностических признаков диагноз аутоиммунного тиреоидита носит лишь вероятностный характер.
♦ Послеродовой тиреоидит
Послеродовой тиреоидит является разновидностью аутоиммунного тиреоидита и представляет собой транзиторную дисфункцию щитовидной железы в послеродовом периоде. Распространенность его составляет 5—9 % от всех беременностей. Нарушение функции железы, обнаруженное у женщины на протяжении первого года после родов, в большинстве случаев связано именно с послеродовым тиреоидитом.
Щитовидная железа обладает уникальной способностью накапливать большое количество готовых тиреоидных гормонов, которых было бы достаточно для обеспечения организма на протяжении 2—3 мес. Тиреоидные гормоны преимущественно накапливаются в коллоиде, содержащемся в полости фолликулов. При послеродовом тиреоидите деструкция щитовидной железы связана с транзиторной аутоиммунной агрессией. В ее патогенезе основное значение придается иммунной реактивации или феномену «рикошета», который заключается в резком увеличении активности иммунной системы после ее долгого физиологического подавления во время беременности, что у предрасположенных лиц может приводить к развитию многих аутоиммунных заболеваний. При любом варианте деструктивного тиреоидита происходит массивное разрушение фолликулов, в результате чего избыток тиреоидных гормонов попадает в кровеносное русло, обусловливая симптоматику тиреотоксикоза и все свойственные для него лабораторные сдвиги. Важно отметить, что гипертиреоз связан не с гиперфункцией, а с деструкцией щитовидной железы, поэтому при проведении сцинтиграфии будет определяться сниженное накопление радиофармпрепарата.
К предрасположенным лицам по развитию послеродового тиреоидита прежде всего относятся женщины-носительницы антител к тиреоидной пероксидазе, у которых риск развития послеродового тиреоидита составляет 30—50 %. Кроме того, у пациенток с любой аутоиммунной патологией (например, с сахарным диабетом I типа) риск развития послеродового тиреоидита в 3 раза выше, чем в популяции.
Для классического течения послеродового тиреоидита характерно возникновение транзиторного тиреотоксикоза через 8—14 нед после родов (фаза тиреотоксикоза), за которым следует гипотиреоидная фаза, а через 6—8 мес — восстановление эутиреоза. В ряде случаев послеродовой тиреоидит сразу манифестирует гипотиреоидной фазой, после чего функция щитовидной железы восстанавливается. Наиболее часто послеродовой тиреоидит не имеет выраженных клинических проявлений. У некоторых женщин может наблюдаться только одна из фаз этой патологии. Несмотря на большую частоту, послеродовой тиреоидит часто остается незамеченным, так как его симптомы — слабость, сухость кожи, ломкость и выпадение волос, ухудшение памяти, депрессия — часто относят к нормальным проявлениям послеродового периода. Заболевание в гипертиреоидной фазе может быть спутано с диффузным токсическим зобом. Тем не менее в отличие от последнего болезнь проходит самостоятельно, не требуя никакого лечения. Назначение тиреостатических препаратов может быть неэффективно при послеродовом тиреоидите и даже может ускорить наступление гипотиреоза. Если симптомы тиреотоксикоза выражены, назначают β-адреноблокаторы.
В фазу гипотиреоза должны быть назначены тиреоидные гормоны. При легком и субклиническом течении не следует прекращать кормление грудью. Симптомы гипотиреоидной фазы мало специфичны, поскольку в подавляющем большинстве случаев речь идет о субклиническом гипотиреозе, который выявляется при динамическом наблюдении пациенток-носительниц антител к тиреоидной пероксидазе. В случае, когда уровень ТТТ повышается до 40—50 мЕД/л, назначают заместительную терапию L-тироксином. Спустя 9—12 мес лечение отменяют: при стойком гипотиреозе произойдет повышение уровня 1ТГ, при транзиторном — сохранится эутиреоз.
Хотя заболевание является самоизлечивающимся, исследователи установили, что у 40 % женщин, перенесших послеродовой тиреоидит в фазе гипотиреоза, наступает постоянное снижение активности щитовидной железы через 1 год после родов, а еще у 20 % — через 3—4 года после родов. У женщин, перенесших послеродовой тиреоидит, риск его наступления и после следующих беременностей составляет 70 %.
Тиреотоксикоз и беременность
Синдром тиреотоксикоза является собирательным понятием, которое включает состояния, протекающие с клинической картиной, обусловленной избыточным содержанием тиреоидных гормонов в крови. Термин «тиреотоксикоз» обозначает патологическое состояние, вызванное стойким повышением уровня свободных тиреоидных гормонов в крови. Иногда для обозначения этого состояния используют термин «гипертиреоз/гипертиреоидизм» — состояние, связанное с увеличением уровня свободных тиреоидных гормонов в крови и с повышенным их синтезом и секрецией щитовидной железой. Тем не менее термин «тиреотоксикоз» более адекватно отражает суть заболевания, поскольку гипертиреоз бывает и в нормальных условиях, например при беременности.
Известные в настоящее время заболевания, сопровождающиеся клинической картиной тиреотоксикоза, подразделяют на две группы.
- Тиреотоксикоз, сочетающийся с гипертиреоидизмом:
- тироксическая аденома;
- многоузловой токсический зоб;
- тиротропинома;
- трофобластическая опухоль;
- аденоматозные разрастания яичника при его атрофии и склерозе;
- рак щитовидной железы;
- гипертиреоидная фаза аутоиммунного тиреоидита;
- диффузный токсический зоб.
- Тиреотоксикоз, протекающий без гипертиреоидизма:
- подострый тиреоидит;
- послеродовой и безболезненный тиреоидит;
- радиационный тиреоидит;
- тиреоидит, вызванный приемом амиодарона или α-интерферона.
Патологический тиреотоксикоз во время беременности развивается относительно редко. Его распространенность составляет 1—2 случая на 1000 беременностей. Практически все случаи гипертиреоза у беременных связаны с диффузным токсическим зобом (болезнью Грейвса). Болезнь Грейвса — это системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору ТТГ, клинически проявляющееся увеличением щитовидной железы с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией.
По современным представлениям, выявление у пациентки болезни Грейвса не является противопоказанием для пролонгирования беременности. Следует отметить, что тиреотоксикоз в меньшей степени, чем гипотиреоз, приводит к снижению фертильности. Однако у женщин со среднетяжелым и тяжелым течением болезни бесплодие развивается почти в 90 % случаев.
Диагностика. Диагностика болезни Грейвса во время беременности основывается на комплексе клинических данных и результатов лабораторно-инструментального исследования, причем наибольшее число диагностических ошибок связано с дифференциальной диагностикой болезни Грейвса и транзиторного гестационного гипертиреоза. Транзиторный гестационный гипертиреоз не требует какого-либо лечения и постепенно с увеличением срока беременности проходит самостоятельно.
Одним из первых признаков тиреотоксикоза на фоне беременности часто является рвота беременных. При этом диагностика тиреотоксикоза может быть затруднена, так как беременность часто и без патологии щитовидной железы осложняется рвотой в ранние сроки. Характерные симптомы тиреотоксикоза — потливость, чувство жара, сердцебиение, нервозность, увеличение железы — также часто встречаются при нормально протекающей беременности. Однако специфичные для болезни Грейвса глазные симптомы могут быть ключом к диагнозу, но для точного заключения о наличии заболевания требуется проведение анализов крови с определением уровней тиреоидных гормонов и ТТГ.
Длительно существующий тиреотоксикоз опасен развитием невынашивания беременности, врожденных уродств у ребенка. Тем не менее при правильном и своевременном лечении тиреостатическими препаратами риск указанных осложнений не выше, чем у здоровых женщин.
Лечение. При впервые выявленной во время беременности болезни Грейвса всем пациенткам показано проведение консервативного лечения. В качестве единственного показания для оперативного лечения на фоне беременности в настоящее время рассматривается непереносимость тиреостатиков. Сразу же после операции беременным назначают L-тироксин в дозе 2,3 мкг/кг массы тела.
При нелеченом и неконтролируемом диффузном токсическом зобе имеется большая вероятность спонтанного прерывания беременности. В связи с этим терапию необходимо проводить так, чтобы на протяжении всей беременности поддерживалось эутиреоидное состояние при использовании наименьших доз антитиреоидных препаратов.
В течение I триместра беременности применение любых лекарственных препаратов крайне нежелательно в связи с возможным их тератогенным влиянием. Поэтому при тиреотоксикозе легкой степени антитиреоидных препаратов можно не назначать. Более того, беременность сама по себе оказывает положительное влияние на течение диффузного токсического зоба, что проявляется в необходимости снижения дозы или даже отмены антитиреоидных препаратов в III триместре.
Стандартное лечение проводят таблетированными тиреостатическими препаратами: производными имидазола (тиамазол, мерказолил) или пропилтиоурацилом, причем последний является препаратом выбора во время беременности, так как в меньшей степени проникает через плаценту и достигает организма плода. Дозу препарата подбирают так, чтобы поддерживать уровень тиреоидных гормонов на верхней границе нормы или несколько выше ее, так как в больших дозах, которые полностью нормализуют уровень Т4, эти препараты проникают через плаценту и могут приводить к снижению тиреоидной функции и к формированию зоба у плода. Основной целью тиреостатической терапии во время беременности является поддержание уровня свободного Т4 на верхней границе нормы (21 ммоль/л). Принципы лечения болезни Грейвса во время беременности состоят в следующем.
- Необходимо ежемесячно определять уровень свободного Т4.
- Препаратом выбора является пропилтиоурацил.
- При тиреотоксикозе средней тяжести, впервые выявленном во время беременности, пропилтиоурацил назначают в дозе 200 мг в день в 4 приема.
- После снижения уровня свободного Т4 до верхней границы нормы дозу пропилтиоурацила сразу снижают до поддерживающей (25— 60 мг/сут).
- Добиваться нормализации уровня ТТГ и часто исследовать этот показатель нет необходимости.
- Назначение L-тироксина (схема «блокируй и замещай») во время беременности не показано.
- При чрезмерном снижении уровня свободного Т4 тиреостатик отменяется и при необходимости назначается вновь.
- С увеличением срока беременности закономерно происходит уменьшение тяжести тиреотоксикоза и снижение потребности в тиреостатике, у большинства беременных в III триместре беременности пропилтиоурацил отменяют.
- После родов (через 2—3 мес) в 100 % случаев развивается рецидив тиреотоксикоза, требующий назначения тиреостатика.
- При приеме малых доз пропилтиоурацила (100 мг/сут) грудное вскармливание безопасно для ребенка.
При тиреотоксикозе средней тяжести стартовая доза пропилтиоурацила не должна превышать 200 мг в день (по 50 мг 4 раза в день). На фоне приема такой дозы уровень свободного Т4 в подавляющем большинстве случаев приходит к верхней границе нормы через 3—4 нед. После того как это произойдет, дозу пропилтиоурацила необходимо снизить до поддерживающей, которая вначале составляет 50—75 мг в день. Уровень свободного Т4 необходимо контролировать ежемесячно, при этом доза тиреостатика, как правило, ежемесячно уменьшается и достигает 25— 50 мг в день. Закономерное уменьшение выраженности тиреотоксикоза при болезни Грейвса и снижение потребности в тиреостатике объясняется тем, что беременность сопровождается физиологической иммуносупрессией и снижением продукции антител к рецептору ТТГ, во-вторых, значительно увеличивается связывающая способность белков-переносчиков гормонов, что приводит к снижению свободных фракций Т3 и Т4.
Кроме того, во время беременности изменяется баланс соотношения антител, блокирующих и стимулирующих рецепторы ТТГ.
При наличии показаний операция на щитовидной железе может быть проведена во время беременности, но в настоящее время назначается пациенткам только при невозможности консервативного лечения. Операция безопасна во II триместре беременности (между 12 и 26 нед).
После родов, обычно спустя 2—4 мес, происходит утяжеление тиреотоксикоза, требующее назначения тиреостатиков. Однако зачастую светлого промежутка бывает достаточно для безопасного грудного вскармливания. При необходимости назначения тиреостатиков и в послеродовом периоде пациентка может кормить грудью ребенка, если она принимает умеренную или низкую дозу тиамазола.
Проблемы лечения болезни Грейвса во время беременности в отдельных случаях не ограничиваются ликвидацией тиреотоксикоза у женщины. Поскольку стимулирующие антитела к рецептору ТТГ проникают через плаценту, они могут вызывать транзиторный гипертиреоз у плода и новорожденного. Транзиторный неонатальный тиреотоксикоз встречается всего у 1 % детей. К признакам неонатального тиреотоксикоза у плода относятся увеличение щитовидной железы, по данным УЗИ, тахикардия более 160 уд/мин, задержка роста и повышение двигательной активности. В этих случаях беременной целесообразно назначать большие дозы тиреостатика при необходимости в сочетании с L-тироксином для поддержания у нее эутиреоза. Тем не менее чаще транзиторный гипертиреоз развивается после родов и проявляется сердечной недостаточностью, зобом, проптозом, желтухой и тахикардией.
Необходимо помнить, что если женщина ранее оперировалась или получала лечение радиоактивным йодом по поводу болезни Грейвса, то она может иметь в крови тиреостимулирующие антитела при отсутствии повышения функции щитовидной железы. В такой ситуации у новорожденного все же может возникнуть неонатальный тиреотоксикоз, даже если у матери тиреотоксикоз отсутствует.
Планирование беременности у женщин с заболеваниями щитовидной железы
По современным представлениям, подавляющее большинство женщин с патологией щитовидной железы после проведения соответствующего лечения под наблюдением эндокринолога могут планировать беременность, которая при адекватном контроле не будет сопряжена с существенным повышением риска акушерско-гинекологических осложнений и развития патологии у плода.
Беременность без отлагательств могут планировать:
- Женщины с компенсированным первичным гипотиреозом, развившимся в исходе аутоиммунного тиреоидита или хирургического лечения неопухолевых заболеваний щитовидной железы.
- Пациентки с различными формами эутиреоидного зоба (узловой, многоузловой, смешанный), когда отсутствуют прямые показания для оперативного лечения (значительный размер узлового зоба, компрессионный синдром).
- Женщины с носительством антител к щитовидной железе при отсутствии нарушения ее функции.
У всех перечисленных женщин во время беременности необходимо проводить динамическую оценку функцию щитовидной железы, подразумевающую определение уровня ТТГ и свободного Т4 в каждом триместре беременности. Помимо того, беременным с зобом необходимо проводить динамическое ультразвуковое сканирование.
Женщины с некомпенсированным гипотиреозом в исходе аутоиммунного тиреоидита или после оперативного лечения неопухолевой патологии щитовидной железы могут планировать беременность после достижения эутиреоза на фоне заместительной терапии L-тироксином. Если женщина по поводу токсического зоба получала терапию 1311, то при условии поддержания эутиреоза беременность можно планировать примерно через 6—12 мес.
Пациенток с тиреотоксикозом необходимо информировать о необходимости надежной контрацепции до полного излечения заболевания, которое при условии небольших размеров зоба и отсутствии неудачных курсов тиреостатической терапии в прошлом достигается у 30 % пациенток. После достижения стойкой ремиссии беременность может быть разрешена спустя 2 года. Если проводилась терапия радиоактивным йодом — беременность следует отложить на 1 год. При оперативном лечении болезни Грейвса беременность может быть планирована в ближайшие сроки на фоне заместительной гормональной терапии.
Заболевания надпочечников и беременность
Физиология надпочечников
Надпочечники являются парными органами внутренней секреции, расположены над верхними полюсами почек на уровне позвонков от ThXI до L[. Имеют вид вертикально стоящих плоских пластинок в виде пирамиды или треугольника.
Средняя масса обоих надпочечников 10—12 г. Размеры в среднем 4,5 х 2—3 см, толщина 0,6— 1 см. Левый надпочечник больше правого.
Зачатки надпочечников плода образуются на 31-е сутки эмбриогенеза, а к 16 нед достигают наибольших размеров и превосходят по величине почки. Возможны добавочные надпочечники, расположенные как внутрибрюшинно, так и забрюшинно.
Надпочечники состоят из коркового и мозгового вещества.
Корковое вещество имеет клубочковую, пучковую и сетчатую зоны.
Надпочечники играют огромную роль в адаптационно-приспособительных реакциях организма, влияют на менструальную функцию, контролируют ряд обменных процессов.
Биосинтез и секреция гормонов корковым веществом надпочечников зависят от целого ряда биологически активных соединений, имеющихся в надпочечниках, в частности простагландинов, микроэлементов (кальция, калия), и от возраста.
Функцию надпочечников контролируют гипофиз и тканевые кортиколиберины.
Адренокортикотропный гормон (АКТГ) начинает синтезироваться в гипофизе плода с 9—11 нед беременности. Регулятором секреции глюкокортикостероидов и андрогенов является кортикотропин, а главным регулятором секреции альдестерона — ангиотензин (особенно II и III).
Надпочечники выделяют более 50 гормонов, из них 41 — корковым веществом надпочечников, а остальные — мозговым веществом.
В корковом веществе надпочечников вырабатываются кортикостероиды:
- в клубочковой зоне продуцируются минералокортикостероиды — альдостерон и др.;
- в пучковой — глюкокортикостероиды (основной гормон у человека — кортизол — гидрокортизол) и кетостероиды;
- в сетчатой — андрогены (дегидроэпиандростерон, андростендион, тестостерон).
В мозговом веществе — адреналин и норадреналин (катехоламины).
♦ Гормоны коркового вещества надпочечников
По физиологическому эффекту кортикостероиды делятся на 3 группы.
I группа (синтезируется клубочковой зоной): альдостерон, 11-дезоксикортикостерон и другие минералокортикостероиды.
Эта группа кортикостероидов преимущественно оказывает влияние на обмен электролитов (калия, натрия) и на выделение воды.
Наиболее активным среди минералокортикостероидов является альдостерон, который способствует задержке натрия и воды в организме. При недостаточности альдостерона натрий выводится с мочой. Уменьшение количества натрия, поступающего с пищей, повышает секрецию альдостерона. Недостаточность калия ослабляет секрецию альдостерона.
Недостаточность минералокортикостероидной функции ведет к болезни Аддисона. Кроме того, альдостерон оказывает некоторое влияние и на углеводный обмен.
II группа (синтезируется пучковой зоной): глюкокортикоиды (17-оксикортикостероиды) — гидрокортизон, кортикостерон, кортизол, 11-дегидрокортикостерон.
О состоянии глюкокортикостероидной функции надпочечников обычно судят по экскреции с мочой производных кортизола — суммарных 17-оксикортикостероидов (17-ОКС) и суммарной концентрации в крови основных глюкокортикостероидов (11-оксикортикостероидов).
Глюкокортикостероиды оказывают влияние на углеводный, белковый и жировой обмен. Они обладают способностью тормозить развитие лимфоидной ткани. Повышают резистентность организма к различным раздражителям, оказывая адаптивный эффект.
Понижение глюкокортикостероидной функции надпочечников сопровождается адинамией, а усиление — увеличением общего количества лейкоцитов, нейтрофилов, лимфопенией за счет массового разрушения лимфоцитов, эозинопенией, а также редукцией селезенки и лимфатических узлов. Одновременно наступает резкое уменьшение массы и размеров вилочковой железы. Это указывает на функциональную связь между этими железами. Особенно чувствительна к глюкокортикостероидам вилочковая железа в раннем постнатальном периоде.
Глюкокортикостероиды (гидрокортизон) угнетают образование коллагена, ослабляют развитие рубцовой ткани и фагоцитоз.
Эта группа гормонов обладает выраженным противовоспалительным и десенсибилизирующим эффектом.
III группа (синтезируется в сетчатой зоне): половые гормоны — андрогены, гестагены, эстрон. Эти стероиды оказывают действие на матку и яичники. В частности, даже после удаления яичников или в период менопаузы эти гормоны продолжают оказывать влияние на эндометрий. Однако в данном случае надпочечники обладают только вспомогательным действием, не заменяя гонады.
Андрогены надпочечников участвуют в синтезе белка, оказывая анаболическое действие, а также влияют на проявление некоторых вторичных мужских половых признаков.
Дегидроэпиандростерон (ДГЭА) является предшественником синтеза эстриола в плаценте.
Из общего числа кортикостероидов 80 % приходится на нейтральные 17-кетостероиды (17-КС) и 17-оксикортикостероиды (17-ОКС), 1—2 % на альдостерон, остальное — на другие минералокортикостероиды. В небольших количествах синтезируются также стероиды (типа С-19) с андрогенной активностью — андростендиол и 11-оксиандростендиол.
Таблица 10. Показатели экскреции в моче 17-КС и 17-ОКС вне и во время беременности и после родов
| Период обследования | 17-КС, мкмоль/сут | 17-ОКС (свободные), мкмоль/сут | 17-ОКС (суммарные), мкмоль/сут |
| Вне беременности | 20,8-34,6 | 0,11-0,47 | 3,61-20,3 |
| 32-35 нед беременности | 22,26 ± 0,21 | 9,3 + 0,3 | 8,35 ± 0,20 |
| 38-40 нед беременности | 30,79 ± 0,36 | 11,46 ± 0,75 | 10,38 ± 0,14 |
| В родах | 32,38 ± 0,50 | 10,97 ± 0,72 | 11,84 ±0,12 |
| После родов (7-12-й день) | 22,52 ± 0,75 | 7,99 ± 0,25 | 11,45 ±0,75 |
Нейтральные 17-КС представляют суммарную концентрацию многочисленных стероидов, обладающих слабой андрогенной активностью. 5 % от всех 17-КС — это сульфат дегидроэпиандростерона (ДГЭА-сульфат), эпиандростерон, андростендиол и др. Тестостерон и дегидротестостерон составляют 1 % 17-КС.
Принимая во внимание, что 17-КС представляют собой конечный продукт метаболизма адренокортикальных гормонов, в клинической практике используют результаты определения количества этих соединений в моче как критерий функциональной активности коркового вещества надпочечников, в частности его андрогенной функции (табл.10).
Пониженная экскреция 17-КС характерна для болезни Адцисона, гипофизарной кахексии, микседемы и тяжелых инфекционных заболеваний как следствие истощения функции коркового вещества надпочечников.
Косвенным показателем недостаточности функции надпочечников является пониженное содержание глюкозы в крови, взятой натощак (3,3—4,17 нмоль/л).
Избыточное выделение 17-КС, как правило, сопровождается явлениями гиперкортицизма с проявлением вирилизма, акромегалии или синдрома Иценко—Кушинга.
Особенно высокие показатели (300— 700 мкмоль/сут) наблюдаются при андростероме (опухоли надпочечников).
♦ Гормоны мозгового вещества надпочечников
В мозговом веществе надпочечников хромаффиноцитами выделяются биогенные амины: адреналин, норадреналин и дофамин, составляющие группу катехоламинов.
Эти гормоны оказывают влияние на сердечнососудистую, гипоталамо-гипофизарную системы. Норадреналин и дофамин синтезируются также в головном мозге, в симпатических окончаниях и скоплениях хромаффинной ткани.
Адреналин продуцируется адреноцитами. Под действием адреналина повышается систолическое артериальное давление, а диастолическое остается неизмененным. Увеличиваются минутный объем сердца и частота сердцебиений. Кроме того, он оказывает непосредственный эффект на миокард. Адреналин стимулирует выработку кортикотропина передней долей гипофиза, активирует биосинтез гормонов в корковом веществе надпочечников и оказывает тормозящее действие на гормональную функцию яичников.
Норадреналин продуцируется норадреноцитами, повышает систолическое и диастолическое давление, слегка снижает минутный объем сердца, замедляет частоту сердечных сокращений и не увеличивает возбудимость миокарда.
Результаты измерения уровня катехоламинов в моче при беременности представлены в табл.11.
Оба гормона оказывают расширяющее действие на венечные сосуды сердца (в большей степени норадреналин), сокращающее действие на сосуды кожи.
Под влиянием этих гормонов повышается уровень глюкозы в крови за счет исчезновения гликогена из мышц и увеличения гликогенолиза в печени.
Кроме влияния на углеводный обмен, адреналин оказывает действие и на жировой обмен, усиливая поглощение кислорода, приводящее к повышению температуры тела и основного обмена.
Имеется взаимосвязь между действием гормонов мозгового и коркового вещества надпочечников. При стрессовых реакциях или инъекции адреналина повышается активность глюкокортикостероидной функции коркового вещества надпочечников, причем адреналин действует на корковое вещество надпочечников не прямо, а через АКТГ гипофиза.
Кроме того, кортикостероиды сами участвуют в регуляции обмена катехоламинов и контролируют их содержание в тканях. В гипоталамусе катехоламины (адреналин и норадреналин) вызывают два типа эффектов, сопряженных с взаимодействием этих веществ с а- и β-адренорецепторами.
Таблица 11. Содержание катехоламинов в моче вне и во время беременности
| Период обследования | Адреналин, нмоль/сут | Норадреналин, нмоль/сут |
| Вне беременности | 32,5 ± 2,2 | 76,6 ± 6,3 |
| II триместр | 20-26 | 52-70 |
| III триместр | 25-50 | 77-90 |
а-Адренергическое действие заключается в:
- сужении сосудов;
- сокращении матки;
- расслаблении гладких мышц желудка, кишечника и мочевого пузыря.
β-Адренергическое действие выражается в:
- регуляции сердечной деятельности;
- торможении перистальтики кишечника и желудка;
- расширении сосудов.
Влияние катехоламинов на сердце в основном опосредовано через β-адренорецепторы. Взаимоотношения между корковым веществом надпочечников и гипофизом определяются принципом обратной связи. Длительное введение глюкокортикостероидов тормозит выделение АКТГ из гипофиза и как следствие вызывает функциональную несостоятельность коры надпочечников.
Гормоны коркового вещества надпочечников оказывают важное влияние на процессы адаптации. При стрессовых реакциях происходит выброс из гипофиза АКТГ с последующей стимуляцией коркового вещества надпочечников. Таким образом, обеспечивается резистентность организма к неблагоприятным условиям. Однако при длительном воздействии вредного фактора адаптационное действие гормонов гипофиза на корковое вещество надпочечников может оказаться недостаточным и в дальнейшем продукция гормонов надпочечников снижается, уменьшаются размеры вилочковой железы, селезенки и лимфатических узлов, наступают лимфопения, эозинопения, возникают трофические расстройства (острая язва желудка и тонкой кишки, отечность, исчезновение жировой ткани и др.).
Имеется определенная взаимосвязь между корковым веществом надпочечников и яичниками в связи с тем, что корковое вещество яичников и надпочечников в период эмбрионального развития образуются из близких мезодермальных зачатков. Гормоны их близки по общему химическому строению и относятся к стероидам. После удаления яичников надпочечники несколько уменьшаются и, наоборот, эстрогены вызывают увеличение массы надпочечников. Следовательно, длительное назначение эстрогенов может привести к андрогенизации.
♦ Изменение функции надпочечников при беременности
Во время беременности происходит повышение функциональной активности коркового вещества надпочечников, что связано с секрецией плацентой АКТГ и кортизоноподобных веществ, изменением метаболизма кортизола в печени, повышением уровня транскортина в крови и гиперэстрогенией. Кроме того, циркулирующий в избытке кортизол при нормально протекающей беременности обладает сниженной биологической активностью. Плацента проницаема для кортикостероидов как материнского, так и плодового происхождения.
Этиология и клинические формы заболеваний надпочечников
Заболевания коры надпочечников протекают с явлениями гипо- или гиперфункции. Причинами дисфункции коры надпочечников являются неполноценность ферментативных процессов, врожденная гиперплазия коры надпочечников в результате генетического дефекта одной или нескольких ферментных систем. Изменения ферментных систем в корковом веществе надпочечников могут быть причиной первичного гипер- и гипоальдостеронизма, протекающих с симптомами гипо- и гиперкортицизма.
Этиология заболеваний коры надпочечников:
- врожденные дефекты в синтезе кортикостероидов;
- хронические инфекционные болезни;
- опухолевые процессы;
- аутоиммунные нарушения;
- изменения центральных механизмов регуляции функции коры надпочечников.
Выделяют следующие клинические формы заболеваний надпочечников.
- I. Гипокортицизм.
- Хроническая надпочечниковая недостаточность:
а) первичная (болезнь Аддисона, атрофия коры надпочечников);
б) вторичная (гипоталамо-гипофизарная недостаточность с понижением секреции АКТГ).
- Острая надпочечниковая недостаточность.
- II. Гиперкортицизм.
- Первичный: гормонпродуцирующие опухоли коры надпочечников (кортикостерома) — синдром Иценко—Кушинга.
- Вторичный: гиперплазия коры надпочечников в результате повышенной секреции АКТГ: болезнь Иценко—Кушинга, которая обусловлена первичным поражением подкорковых и стволовых образований (лимбическая зона, гипоталамус) с последующим вовлечением гипофиза (аденома гипофиза), коры надпочечников и развитием гиперкортицизма.
III. Дисфункция коры надпочечников: адреногенитальный синдром (АГС).
Гипокортицизм и беременность
Хроническая надпочечниковая недостаточность является результатом двусторонних деструктивных поражений, чаще всего бактериального происхождения (туберкулез) или результатом действия неспецифических факторов.
Заболевание возникает также после двусторонней адреналэктомии и у больных, длительно получавших стероидные гормоны по поводу различных заболеваний (бронхиальная астма, ревматизм и др.).
При этих процессах происходит уменьшение выработки гормонов коркового вещества надпочечников — кортизола, альдостерона и увеличение продукции меланоформного гормона.
На обзорных рентгенограммах брюшной полости в 25 % случаев наблюдаются участки обызвествления над верхними полюсами почек, имеющие крапчатую структуру. Диагноз устанавливают на основании исследования уровня кортизола в крови, альдостерона, выделения глюкокортикостероидов — 17-ОКС и нейтральных кетостероидов — 17-КС с мочой. При пробах с АКТГ повышения этих показателей не наблюдается.
Клиническая картина заболевания характеризуется следующими симптомами:
- прогрессирующая слабость;
- постоянная утомляемость;
- бессонница;
- усталость;
- гипотония;
- психическая астения;
- отсутствие аппетита;
- тошнота;
- рвота;
- запоры, сменяющиеся поносами;
- боли в животе;
- снижение массы тела.
При болезни Аддисона одним из характерных симптомов является прогрессивно нарастающая мышечная слабость, снижение тонуса скелетной и гладкой мускулатуры, гиперпигментация кожи и слизистых оболочек (меланоз) пропорционально тяжести заболевания. Меланоз сначала проявляется на уровне кожных складок и бороздок (большие половые губы, скулы, десна), приобретая в последующем диффузный характер. Меланоз обусловлен понижением продукции корковым веществом надпочечников альдостерона и кортизона и повышенной продукцией меланоформного гормона гипофиза.
Вследствие дефицита глюкокортикостероидов развиваются гипотония, гипогликемия, происходит потеря массы тела и нарушение функции пищеварения, сердечно-сосудистой системы. Возможно абсолютное уменьшение величины сердца (за счет артериальной гипотонии).
При стрессовых реакциях: инфекциях, психических травмах, хирургических вмешательствах, при беременности и в родах — наступает резкая гипотония, обезвоживание — аддисоновый криз. Клинически он проявляется симптомами гипотонии, гипогидратации, сосудистым коллапсом, нарушением функции почек. При надпочечниковой недостаточности может иметь место гуморальный синдром, который характеризуется:
- снижением в крови уровня хлора, холестерина и натрия;
- повышением в крови уровня азота и глюкозы;
- увеличением в моче уровня хлора и натрия.
Лечение криза должно осуществляться путем немедленного применения больших доз стероидных гормонов.
Лечение больных с хронической недостаточностью надпочечников заключается в использовании препаратов, обладающих минералокортикоидным (ДОКСА) или глюкокортикостероидным действием — кортизон, гидрокортизон, преднизолон, дексаметазон. Поддерживающее лечение осуществляют путем имплантации под кожу ДОКСА.
Беременность при гипокортицизме обычно наступает после хирургического лечения или терапии преднизолоном. Несмотря на лечение, у этих больных остается хроническая недостаточность надпочечников.
Условия положительного прогноза течения беременности:
▲ После адреналэктомии беременность рекомендуется спустя год в случае компенсации надпочечниковой недостаточности и при постоянном приеме небольших доз препаратов коры надпочечников.
▲ Пролонгирование беременности разрешается при отсутствии обострения и наличии эффективности соответствующей терапии.
▲ Беременные, перенесшие ранее адреналэктомию, подлежат диспансерному наблюдению эндокринолога и акушера.
При беременности, сопровождающейся гипокортицизмом, встречается целый ряд осложнений.
Так, возможно развитие острого криза сопровождающегося надпочечниковой недостаточностью. При этом выделяют три периода, опасные в отношении развития криза: ранние сроки беременности; роды; послеродовой период.
Характерно развитие гестоза с ранних сроков беременности, приводящего к нарушению электролитного баланса, потере жидкости, гипогликемическому и гипохлоремическому состоянию. Возможно перенашивание беременности вследствие низкой продукции эстрогенов. Не исключается преждевременная отслойка плаценты.
С 28—30 нед беременности наступает клиническое улучшение состояния беременной благодаря фетальной, плацентарной и супраренальной секреции кортизона и альдостерона. Однако эти сдвиги не дают права прекращать гормональное лечение.
III триместр беременности, особенно последние 4—5 нед, переносится тяжелее. Возможны развитие и усугубление гестоза, связанные с применением стероидных гормонов. Иногда наблюдается и благоприятное течение беременности вследствие компенсаторной «помощи» гормонов плода и плаценты, и беременные не нуждаются в лечении. Пигментация кожи исчезает.
Критическим периодом для развития аддисонова криза являются роды, которые квалифицируются как стресс. Повышенная кровопотеря усугубляет течение криза.
Опасность развития криза существует и в 1-е сутки послеродового периода, что связано с резким падением продукции кортикостероидов из-за рождения плода, отсутствием плаценты и неизбежной кровопотерей в родах.
В процессе ведения беременных при гипокортицизме следует соблюдать ряд условий. Необходимо проводить контроль за массой тела, содержанием электролитов крови, артериальным давлением, состоянием сердечно-сосудистой системы, уровнем глюкозы в крови. Проводят тщательный контроль за состоянием фетоплацентарной системы. Необходимо осуществлять своевременную профилактику и диагностику ФПН и гестоза (принимая во внимание назначение кортикостероидов). Пролонгирование беременности при болезнью Аддисона возможно с большой осторожностью и только при доброкачественном течении заболевания. Целесообразно госпитализировать беременных в стационар в I триместре, в 28 нед и за 3 нед до родов. При нарастающих явлениях надпочечниковой недостаточности, не поддающейся терапии, показано досрочное родоразрешение. В случае прерывания беременности накануне в течение 2 дней назначают преднизолон или 125 мг гидрокортизона с повторением его сразу же после аборта.
Во время беременности продолжают систематическое лечение глюкокортикостероидами.
В первой половине беременности назначают преднизолон по 10—15 мг/сут или дексаметазон 1—2 мг/сут и ДОКСА по 5 мг внутримышечно через 2 дня.
Во второй половине беременности дозу преднизолона уменьшают до 5 мг/сут или дексаметазона до 0,5 мг/сут и подключают ДОКСА для улучшения электролитного обмена (задерживает в организме ионы натрия и повышает выделение калия).
Доза гормональных препаратов подбирается под контролем уровня 17-КС.
Дополнительно рекомендуют полноценное питание, поваренную соль до 10 г, аскорбиновую кислоту 1 г сутки, ограничивают прием солей калия.
В родах и в 1-е сутки послеродового периода при гипокортицизме может возникнуть острая надпочечниковая недостаточность. У пациенток, которые получали преднизолон, в послеродовом периоде может развиться обезвоживание в связи с усиленным диурезом и отсутствием в материнском организме плода и плаценты как гормонально-активного комплекса. Нередко в родах отмечается слабость сократительной активности матки.
Тактика ведения родов при гипокортицизме должна быть выжидательной. Роды целесообразно вести через естественные родовые пути. Оперативное родоразрешение выполняется только по строгим показаниям. В родах обязательно проводят адекватное поэтапное обезболивание. Путем своевременного устранения слабости родовой деятельности предупреждают затяжное течение родов. В первом периоде родов вводят внутривенно капельно 500 мл 5 % раствора глюкозы, 0,9 % раствора хлорида натрия, 1 мл 0,06 % корглюкона, 10 мл 5 % раствора аскорбиновой кислоты. Вводят также гидрокортизон 50 мг внутримышечно, затем 5 мг ДОКСА. Это лечение повторяют каждые 3—4 ч. Лечение проводят под контролем артериального давления. При падении артериального давления повторяют введение ДОКСА.
Обязательной является профилактика кровотечения в третьем периоде родов и раннем послеродовом периоде. Кровопотеря должна быть минимальной и полностью возмещенной.
В послеродовом периоде интервал введения гидрокортизона и ДОКСА увеличивается одновременно с последующим переходом на его прием внутрь.
На 3—4-й день после родов гидрокортизон назначают по 50 мг через 8 ч и ДОКСА 5 мг 1 раз в сутки.
На 5-е сутки назначают гидрокортизон 50 мг 2 раза в день и преднизолон 10—15 мг.
На 7—8-е сутки — гидрокортизон 50 мг утром и преднизолон — 10—15 мг.
В дальнейшем больных переводят на фиксированные дозы, применявшиеся ранее. При передозировке стероидных гормонов возникают гипертензия, отечный синдром, диспепсические явления.
Лечение стероидными гормонами проводят под контролем артериального давления и в зависимости от уровня 17-КС, 17-ОКС.
В случае необходимости выполнения планового абдоминального родоразрешения за сутки до операции назначают гидрокортизон по 50 мг внутримышечно 3 раза в течение дня. В день операции — 75 мг гидрокортизона внутримышечно, по ходу операции внутривенно капельно 75— 100 мг гидрокортизона в изотоническом растворе хлорида натрия. Обязательным является адекватное восполнение кровопотери.
При данной патологии здоровые новорожденные рождаются с частотой 1:500. Нередко имеет место гипотрофия плода, возможны врожденные аномалии до 2 %. Мертворождаемость в среднем отмечается в 3 случаях на 100 родов.
Гиперкортицизм и беременность
Гиперфункция коры надпочечников связана с повышенным образованием кортиколиберинов, увеличением выделения АКТГ с последующей стимуляцией функции надпочечников. К патологии коры надпочечников с проявлением первичного гиперкортицизма относится опухоль коры надпочечников — кортикостерома (синдром Иценко—Кушинга) или опухоли других органов, продуцирующие АКТГ-подобные вещества.
Вторичный гиперкортицизм функционального генеза развивается вследствие нарушений в гипоталамо-гипофизарно-надпочечниковой системе или в результате кортикотропного влияния аденомы гипофиза (болезнь Иценко—Кушинга).
Первичный гиперкортицизм. При первичном гиперкортицизме проявления заболевания обусловлены опухолью коры надпочечников — кортикостеромой, которая встречается в 25—30% наблюдений при гиперкортицизме. При этой опухоли происходит избыточное выделение глюкокортикостероидов, отчасти андрогенов или эстрогенов и минералокортикостероидов.
При синдроме Иценко—Кушинга надпочечники слегка увеличиваются. Отмечаются атрофические изменения органов репродуктивной системы. Имеют место нарушения менструальной и репродуктивной функции (аменорея, бесплодие).
В связи с этим беременность наступает только на начальных стадиях заболевания или после гормональной терапии основного заболевания.
Общая симптоматика синдрома Иценко—Кушинга характеризуется гипофизарно-надпочечниково-яичниковыми нарушениями с выраженным проявлением гирсутизма и эндокринно-обменными нарушениями. При кортикостероме происходит нарушение всех видов обмена.
У этих больных отмечаются общая слабость; депрессия; сухая кожа со склонностью к гиперкератозу; пигментные пятна; гипертрихоз; striae atrophicae на животе, ягодицах, реже — на плечах и бедрах; гиперпигментация; лунообразное лицо; отложение жира на животе и туловище; остеопороз; искривление позвоночника; спонтанные переломы костей; задержка жидкости; неврологические нарушения; сердечно-сосудистые нарушения; артериальная гипертензия (вследствие гиперкалиемии); скудные менструации или аменорея (вследствие изменений гипоталамо-гипофизарных механизмов регуляции менструальной функции под влиянием избыточного количества продуцируемых кортикостеромой андрогенов и кортизола); лакторея до 22 % (из-за значительного количества рецепторов пролактина в корковом веществе надпочечников); бесплодие; гипертрофия клитора; гипоплазия матки и яичников; атрофия молочных желез; инсулиноустойчивый стероидный сахарный диабет или гипергликемия; полиглобулинемия; гиперхолестеринемия; увеличение в плазме крови АКТГ; 2—3-кратное увеличение в плазме крови уровня общего и свободного кортизола (в отличие от болезни Иценко—Кушинга); отсутствие дневных колебаний уровня кортизола в плазме крови при пробе с гидрокортизоном; в моче увеличено количество 11-оксикетостероидов.
Для диагностики и дифференциальной диагностики используют определение уровней секреции гормонов; гормональные пробы (дексаметазоновая); УЗИ; КТ надпочечников (лучевая нагрузка при этом методе исследования находится на верхней границе доступной при беременности дозы); определение содержания глюкокортикоидных препаратов в лимфоцитах крови; кристаллографическое исследование сыворотки крови при помощи МРТ.
Беременность у больных с кортикостеромой возникает относительно редко (в 4—8 % случаев). Кортикостеромы у беременных в 18—30 % наблюдений имеют злокачественный характер.
Осложнения беременности при первичном гиперкортицизме чаще всего связаны с ухудшением течения основного заболевания, нарушением состояния плода, что сопровождается значительным возрастанием уровня 17-КС, 17-ОКС, некоторым увеличением прегнандиола, прегнантриола, снижением количества эстрогенов (особенно эстриола). Беременность часто осложняется самопроизвольным абортом, мертворождением. Нередко имеет место раннее развитие тяжелых форм гестоза. Вследствие снижения эстриола и развития гестоза возникает внутриутробная асфиксия и задержка развития плода.
Независимо от срока беременности при кортикостероме показано удаление опухоли и прерывание беременности. Прерывать беременность рекомендуется в сроки до 12 нед с применением усиленной стероидной терапии.
В случае сохранения беременности во II триместре проводят лечение метапироном вплоть до родов (500 мг каждые 6 ч).
В III триместре рекомендуется срочное родоразрешение после подготовительной симптоматической терапии.
Вопрос о тактике ведения беременности у женщин, подвергшихся ранее тотальной адреналэктомии, заключается в назначении им кортикостероидной терапии, так как после адреналэктомии к концу беременности и особенно в родах возникает реальная угроза острой надпочечниковой недостаточности.
Во время беременности осуществляют тщательный контроль за состоянием фетоплацентарной системы. Следует проводить своевременную профилактику, диагностику гестоза и ФПН.
Досрочное родоразрешение проводится по показаниям.
Ведение родов должно быть выжидательным. В родах показана интенсивная глюкокортикостероидная терапия. Следует проводить адекватное обезболивание и профилактику кровотечения. Показания к кесареву сечению строго акушерские.
Роды после двусторонней адреналэктомии на фоне адекватной заместительной терапии протекают так же, как и у здоровых женщин. Однако следует помнить, что у этих женщин в родах существует угроза развития острой надпочечниковой недостаточности. В связи с этим в родах следует повышать дозу кортикостероидов и использовать парентеральное их введение.
В послеродовом периоде с 1-х суток назначают кортикостероидную терапию под контролем уровня экскреции 17- КС. Период лактации может ухудшить течение основного заболевания.
Дети матерей, страдающих гиперкортицизмом, рождаются с признаками гипотрофии, с чертами диабетиков, что связано с нарушением углеводного обмена у матери. В период новорожденности отмечается снижение адаптационных реакций, возможно развитие гипогликемии. Эти дети должны находиться на диспансерном учете у эндокринолога и невропатолога. При развитии надпочечниковой недостаточности им назначают глюкокортикостероиды. Однако, с другой стороны, как показывают результаты клинических наблюдений, подавляющее большинство детей, родившихся от матерей, страдающих кортикостеромой, но находившихся в стадии стойкой клинической ремиссии и компенсации надпочечниковой недостаточности, оказываются практически здоровыми, без выраженных изменений в эндокринной системе.
Вторичный гиперкортицизм (болезнь Иценко—Кушинга). Обусловлен поражением подкорковых и стволовых образований (лимбическая зона, гипоталамус) с последующим вовлечением гипофиза с развитием аденомы, формированием вторичной гиперплазии коркового вещества надпочечников и гиперкортицизма.
Аденома гипофиза характеризуется усиленным выделением его передней долей АКТГ, нарушением функции гипоталамо-гипофизарно-надпочечниковой системы с избыточной секрецией всех стероидов корковым веществом надпочечников, особенно 11-ОКС.
Количество 17-ОКС увеличено в 2—3 раза, а 17-КС незначительно (в противоположность адреногенитальному синдрому, кортикостероме и др.).
Клинические проявления болезни Иценко— Кушинга во многом идентичны синдрому Иценко—Кушинга различного генеза с выраженными нарушениями обменных процессов, изменениями в гипоталамо-гипофизарно-яичниковой системе и др. Отличительной особенностью болезни Иценко—Кушинга является то, что концентрация кортизола ниже, чем у пациенток с синдромом Иценко—Кушинга. Все эти клинические признаки представляют собой существенный фактор риска возможности нарушений развития плода и новорожденного.
По данным рентгенокраниографии, только через несколько лет от начала болезни турецкое седло становится разреженным и слегка увеличенным в размерах, так как кортикотропные аденомы имеют малые размеры. Часто выявляется разлитая или очаговая порозность костей, прилегающих к турецкому седлу. В этой ситуации может быть показана МРТ.
Исходя из динамики изменения состояния турецкого седла, при диагностике данного заболевания необходимо обратить внимание на анамнез, общий статус и данные лабораторного исследования гормонов.
Для установления диагноза и дифференциальной диагностики используют гормональные пробы с дексаметазоном, метапироном.
При дексаметазоновой пробе происходит снижение суточной экскреции 17-ОКС на 15 % и более вследствие торможения дексаметазоном выработки гипофизом АКТГ с последующим уменьшением экскреции 17-ОКС.
При проведении пробы с метапироном (по 500 мг каждые 4—6 ч в течение суток) усиливается экскреция 17-ОКС.
Метапирон подавляет выработку 11β-гидроксилазы — фермента, участвующего в конечном этапе синтеза кортизола, что вызывает снижение его секреции и приводит к усилению секреции АКТГ (по системе обратной связи), при этом повышается уровень 17-ОКС.
При болезни Иценко—Кушинга уровень 17-ОКС значительно повышается в отличие от синдрома Иценко—Кушинга.
Кортикотропную аденому гипофиза от кортикостеромы надпочечников и гиперплазии надпочечников можно дифференцировать и рентгенологически. При кортикотропной аденоме гипофиза надпочечники подвергаются гиперплазии и тень их на рентгенограммах бывает более интенсивной, чем при опухоли надпочечников (кортикостероме).
В случае наступления беременности при активной стадии вторичного гиперкортицизма она должна быть обязательно прервана в ранние сроки.
Благоприятный прогноз течения беременности и исхода родов при болезни Иценко—Кушинга возможен только при полной ремиссии заболевания, при нормализации артериального давления, углеводного обмена и адекватной заместительной терапии.
Вопрос о возможности пролонгирования беременности решается при совместной консультации эндокринолога, специалиста по лучевой диагностике и акушера-гинеколога.
Беременность у этих больных представляет собой фактор высокого риска для жизни матери и ребенка.
Независимо от характера лечения (медикаментозное, лучевое, хирургическое) нормальное течение беременности при болезни Иценко—Кушинга наблюдается лишь в 30 % случаев.
Типичными осложнениями беременности при данной патологии являются угроза прерывания беременности в ранние сроки; преждевременные роды; раннее начало гестоза; артериальная гипертензия.
В процессе ведения беременных необходим тщательный контроль за общим состоянием пациентки; уровнем артериального давления; массой тела; диурезом; наличием отеков; показателями уровня гормонов; содержанием глюкозы крови.
В каждом триместре беременности необходима совместная консультация с эндокринологом для решения вопроса о возможности пролонгирования беременности и гормональной коррекции.
Рекомендуется диета с ограничением соли, углеводов, с назначением витаминов, дифенина (препарата, снижающего функцию коры надпочечников, в дозе 1 таблетка 3 раза в сутки в течение 3 нед).
Типичными осложнениями в родах и в послеродовом периоде при вторичном гиперкортицизме являются слабость родовой деятельности; преждевременное излитие околоплодных вод; усугубление гестоза с высокой артериальной гипертензией; внутриутробная асфиксия плода; острая надпочечниковая недостаточность в раннем послеродовом периоде в результате выключения плацентарных кортикостероидов; осложнения со стороны сердечно-сосудистой системы или кровоизлияние в мозг; кровотечения в последовом и раннем послеродовом периоде; рецидив основного заболевания после родов.
В процессе ведения родов при повышении артериального давления проводят управляемую гипотензивную терапию (арфонад или гигроний); осуществляют адекватное поэтапное обезболивание; оценивают состояние плода в динамике; проводят профилактику аномалий родовой деятельности и кровотечений.
При наличии активной фазы заболевания у пациентки дети рождаются кушингоидного типа из-за внутриутробной недостаточности синтеза стероидных гормонов. Возможно развитие сахарного диабета. Кроме того, может иметь место гипотрофия у новорожденных.
При наличии у новорожденного малой массы тела, низкого уровня артериального давления и повышенной экскреции с мочой 17-КС и 17-ОКС необходимо назначение глюкокортикостероидов. В дальнейшем эти дети должны находиться на диспансерном учете у эндокринолога и невропатолога.
Дисфункция коры надпочечников (адреногенитальный синдром) и беременность
Адреногенитальный синдром (АГС) представляет собой наследственное врожденное заболевание, которое характеризуется неполноценностью ферментных систем, участвующих в синтезе стероидных гормонов коркового вещества надпочечников, что приводит к снижению выработки кортизола. Это обусловливает (по механизму обратной связи) увеличение секреции гипофизом АКТГ, развитие гиперплазии коры надпочечников и активацию синтеза андрогенов с последующим нарушением полового развития и репродуктивной функции.
Частота АГС варьирует от 1 на 5000-10 000 новорожденных.
Чрезмерная выработка андрогенов является главной причиной развития вирилизации женского организма, проявление которого зависит от степени выраженности секреции андрогенов и времени начала реализации данного заболевания.
Адреногенитальный синдром по клиническим признакам разделяют на три формы: врожденную, препубертатную и постпубертатную.
При последней форме нарушение синтеза стероидов длительное время может протекать бессимптомно и компенсироваться за счет гиперплазии надпочечников. Клинические признаки заболевания не проявляются до тех пор, пока какой-либо стрессорный фактор не спровоцирует реализацию скрытой формы нарушения функции коркового вещества надпочечников.
Первые симптомы гиперпродукции андрогенов при постпубертатной форме возникают после завершения процессов окостенения и формирования первичных и вторичных половых признаков.
Для постпубертатной формы АГС характерны следующие клинические признаки: хорошо выраженный женский фенотип; гирсутизм (избыточный рост волос на лице, вокруг сосков, на конечностях); нормальное строение половых органов и молочных желез; нарушения менструальной функции (ановуляция, гипоолигоменорея, аменорея); бесплодие; общая слабость; головные и мышечные боли; снижение работоспособности; артериальная гипотония.
Диагностика типичных случаев АГС не представляет особых затруднений. Важное диагностическое значение имеет определение уровня экскреции метаболитов андрогенов, 17-КС и промежуточных продуктов синтеза глюкокортикостероидов — прогестерона и 17-оксипрогестерона. При АГС экскреция 17-ОКС находится на низком уровне (вследствие дефицита глюкокортикостероидов), а нейтральных 17-КС возрастает в 5—10 раз в сравнении с возрастной нормой. Аналогичным образом изменяется и уровень прегнандиола в моче. В крови значительно повышается концентрация тестостерона, 17-гидрокси-прогестерона и ДГЭА.
Дифференциальную диагностику следует проводить с вирилизирующими опухолями надпочечников, болезнью Иценко—Кушинга, склеро-кистозными яичниками.
Дифференциально-диагностическое значение приобретает дексаметазоновая проба. Препарат оказывает тормозящее влияние на выделение АКТГ, что приводит к снижению экскреции не только суммарных 17-КС, но и андростерона, ДГЭА и прегнандиола.
Проба с АКТГ характеризуется увеличением 17-КС в 3 раза с небольшим увеличением 17‑КС.
Наступление беременности при стертых формах АГС у женщин не такой уж и редкий факт, и свидетельством этому является большой удельный вес надпочечниковой гиперандрогении в структуре причин привычного невынашивания беременности.
Часто при постпубертатной форме АГС, несмотря на то что имеет место овуляция и происходит оплодотворение яйцеклетки, беременность прерывается на ранних сроках до образования плаценты из-за неполноценности желтого тела. Избыточное количество андрогенов вызывает нарушение кровообращения в матке, стаз крови, склеротическое изменение сосудов миометрия и хориона, что приводит к повышению ломкости сосудов, их разрывам. В результате этого возникают кровоизлияния в децидуальную оболочку с образованием ретроплацентарных гематом и частичная отслойка хориона. Частота невынашивания беременности при АГС достигает 26 %.
Важной проблемой является влияние высокого уровня андрогенов у матери на развитие эмбриона и плода при беременности. Известно, что андрогены свободно проникают через плацентарный барьер и оказывают влияние на формирование наружных половых органов у плода женского пола.
Воздействие повышенного уровня андрогенов матери на плод проявляется по-разному в зависимости от стадии внутриутробного развития плода. При действии повышенной концентрации андрогенов в период между 8-й и 12-й неделями наружные половые органы плода женского пола формируются по мужскому типу (женский псевдогермафродитизм), при действии в период между 13-й и 20-й неделями развивается sinus urogenitales, а при действии после 20-й недели отмечается увеличение клитора различной степени.
Кроме того, андрогены могут влиять на формирование и правильное функционирование нейроэндокринных механизмов регуляции и на так называемую половую дифференцировку мозга плода.
Во время беременности необходимо продолжать применение кортикостероидной терапии, начатой до беременности, так как при отмене этих препаратов возможны прерывание беременности и отрицательное влияние гиперандрогении на плод.
Лечение проводят под контролем уровня 17-КС. Обычно из глюкокортикостероидов применяют дексаметазон. При повышенном уровне 17-КС назначают гормон в дозе 0,5 мг или 0,375 мг до нормализации экскреции 17-КС с постепенным снижением дозы до 0,125 мг. Это лечение необходимо сочетать с назначением препаратов калия.
В сроки 16, 20 и 28 нед необходим тщательный контроль за уровнем 17-КС, так как в эти периоды увеличивается продукция гормонов надпочечниками плода.
В связи с широким применением кортикостероидов при беременности увеличивается частота гестоза, что сопровождается фетоплацентарной недостаточностью и нередко задержкой развития плода.
Профилактика прерывания беременности проводится общепринятыми методами.
Своевременно проводят профилактику, диагностику и терапию гестоза и ФПН, контролируют состояние фетоплацентарной системы.
Дети, родившиеся от матерей с АГС, требуют тщательного наблюдения и обследования функции коркового вещества надпочечников.
Первичный альдостеронизм и беременность
- D. Conn в 1955 г. описал первичный альдостеронизм вследствие развития доброкачественной альдостеронпродуцирующей аденомы надпочечника. Эта опухоль чаще встречается у женщин и проявляется клинически во время беременности. При этой опухоли выделение альдостерона увеличивается в 40—400 раз (в норме 5,5— 28 нмоль/сут). Происходят значительные нарушения метаболизма электролитов: гипернатриемия, гипокалиемия с увеличением выделения калия с мочой.
Первичный альдостеронизм может возникнуть как самостоятельное эндокринное заболевание, так и в качестве проявления или последствия сердечной недостаточности, цирроза печени, нефроза, недостаточности калия.
Данное заболевание на фоне усиленной выработки альдостерона сопровождается гипертензией, характеризуется тяжелым течением и требует своевременного лечения.
Клиническими признаками первичного альдесторонизма являются мышечная слабость вследствие гипокалиемии; перемежающиеся параличи, парестезии, судороги, тетания. Отмечаются нарушения со стороны мочевыделительной системы в виде полиурии, полидипсии, никтурии, умеренной протеинурии, щелочной реакции мочи. Имеют место симптомы, связанные с атериальной гипертензией: головные боли, изменения на глазном дне, стойкая диастолическая гипертензия.
Для диагностики данной патологии используют УЗИ; КТ; МРТ. В рамках лабораторных исследований оценивают содержания калия и натрия для выявления гипокалиемии и гипернатриемии; изучают содержание альдостерона, определяют наличие белка в моче.
При первичном альдостеронизме беременность противопоказана и в случае ее наступления должна быть прервана с последующим удалением опухоли и лечением заболеваний, которые привели к ее развитию.
Феохромоцитома и беременность
Феохромоцитома — катехоламинпродуцирующая опухоль, происходящая из мозгового вещества надпочечников или вненадпочечниковой хромаффинной ткани из параганглии чревного, почечного, портального, нижнего подчревного и других сплетений симпатической нервной системы. Хромаффинная ткань окрашивается хромом в бурый цвет (phaeos) — что и послужило основой названия опухоли — феохромоцитома.
Опухоль встречается в возрасте от 2 лет до глубокой старости, одинаково часто у женщин и мужчин. Размер ее от 1 до 15 см, масса от 1 до 75—100 г, обычно односторонняя, заключена в капсулу и имеет округлую форму, чаще поражается правый надпочечник. Гистологически опухоль доброкачественная (до 90—98 %), а клинически протекает злокачественно. Описаны семейные заболевания, установлен аутосомно-доминантный путь передачи.
Симптомы опухоли обусловлены воздействием избыточного количества катехоламинов.
Наблюдаются пароксизмальная тахикардия и внезапные приступы гипертензии до 300/190 мм рт. ст., связанные с периодическим выбросом норадреналина и адреналина.
Гипертонические кризы сопровождаются приступами сердечной астмы, гипергликемией и глюкозурией, лейкоцитозом, повышением температуры тела, появлением болей в конечностях, парестезиями.
В период криза отмечаются резкая бледность лица, конечностей, похолодание кистей и стоп, судороги, одышка, тревога, рвота, головные боли.
Криз может продолжаться до 2—3 ч. Причем при выбросе адреналина криз продолжается несколько минут, так как адреналин разрушается быстро.
При выбросе норадреналина криз длится часами и даже сутками.
Гипертонические кризы могут повторяться 1— 2 раза в день или 1 раз в месяц и сопровождаться рядом вегетативных симптомов в виде головной боли; тошноты; рвоты; тахикардии; потливости; слабости; болей в области сердца, животе, мышцах конечностей; дрожания тела; судорог; гипертермии до 40 °С (объясняется задержкой теплоотдачи из-за спазма сосудов).
В ряде случаев заболевание может протекать и без кризов, но при высоком артериальном давлении. Почечная недостаточность наступает при злокачественном гипертензионном синдроме. Со стороны глазного дна отмечается ангиопатия. По данным ЭКГ, выявляются признаки некоронарогенных некрозов.
При тяжелых кризах возможны кровоизлияние в мозг, психические нарушения, развитие неуправляемой гемодинамики, при которой гипертензия сменяется гипотонией. Все эти явления объясняются интоксикацией катехоламинами.
При феохромоцитоме возможно развитие множественных опухолей в надпочечниках, щитовидной железе, паращитовидных железах.
В этих случаях развиваются мультицентрические опухоли (двусторонняя феохромоцитома и опухоль паращитовидных желез). Чаще подобный процесс встречается при семейных заболеваниях. Метастазирование феохромоцитомы происходит в регионарные лимфатические узлы, печень, легкие, кости.
Для диагностики феохромоцитомы используют обзорную рентгенографию органов брюшной полости, УЗИ, КТ, МРТ. Определяют экскрецию катехоламинов и их метаболита — ванилилминдальной кислоты — в суточной моче после криза. Проводят пробу с тропафеном, которая направлена на блокаду вазопрессорного действия катехоламинов. Для этого внутривенно вводят 1 мл 2 % раствора тропафена. Через 1 мин систолическое артериальное давление снижается на 40—30 мм рт. ст., а диастолическое — на 20—25 мм рт. ст. Выполняют также фентоламиновую пробу. Фентоламин (5 мг) вводят внутривенно или внутримышечно. Проба считается положительной, если через 2 мин систолическое артериальное давление снижается на 30—35 мм рт. ст., а диастолическое — на 20— 25 мм рт. ст.
Феохромоцитома может сочетаться с диабетом в связи с интенсивным распадом гликогена в печени и угнетающим действием адреналина на островки Лангерганса; гиперфункцией щитовидной железы; гиперфункцией коры надпочечников.
Беременность при феохромоцитоме встречается редко и является противопоказанной. Перинатальная смертность при данной патологии составляет 40—50 %, а смертность новорожденных — более 75 %. Материнская летальность достигает 11 %.
Такие неблагоприятные исходы обусловлены тем, что во время беременности при феохромоцитоме имеет место стойкая гипертензия с пароксизмальными кризами. Гипертонические кризы часто сменяются шокоподобным состоянием, нередко с летальным исходом. Происходят кровоизлияния в мозг, в ткань надпочечников или в саму опухоль. Может поражаться сердечно-сосудистая система («катехоламиновый миокардит») с дистрофией и некрозом миофибрилл. Кроме того, нередко происходит преждевременная отслойка плаценты.
У беременных катехоламиновый криз может развиться после перемены положения тела, при схватках в родах, при акушерских исследованиях, при шевелении плода. Внезапная смерть или шок у беременных возможны с появлением первых схваток. Высокая перинатальная смертность объясняется снижением интенсивности МПК из-за большого содержания катехоламинов и преждевременной отслойки плаценты.
Дифференциальный диагноз во время беременности проводят с гестозом, сахарным диабетом, гипертонической болезнью, тиреотоксикозом.
В связи с угрозой жизни и здоровью пациентки при данном заболевании целесообразно убедить беременную и ее семью в необходимости прерывания беременности. При любом сроке беременности показано немедленное удаление опухоли. Прерывание беременности проводят после предварительного удаления опухоли.
В случае пролонгирования беременности во II и III триместрах возможны три варианта тактики хирургического лечения:
1) кесарево сечение с одновременным удалением опухоли;
2) кесарево сечение с последующим удалением опухоли;
3) роды через естественные родовые пути с последующим удалением опухоли.
Предпочтение отдают первому варианту.
Родоразрешение через естественные родовые пути представляет опасность в связи с тем, что при сокращении матки происходит механическое сдавление опухоли с увеличением выброса катехоламинов со всеми вытекающими негативными последствиями.
В родах через естественные родовые пути рекомендуется назначение препаратов, купирующих кризы:
- феноксибензамин (суточная доза от 20 до 200 мг) — эффект наступает через 2 ч после введения и продолжается несколько дней;
- фентоламин (пентамил) — α-адреноблокатор короткого действия;
- нитропруссид натрия — 0,3—0,4 мг на 1 кг массы тела;
- кардиоселективные блокаторы;
- сердечные средства;
- кортикостероиды.