Содержание статьи:
- Внутриутробное инфицирование плода по триместрам развития беременности
- Механизмы защиты плода от инфицирования
- Методы исследования на наличие инфекции во время беременности
- Общие положения по профилактике внутриутробного инфицирования
Внутриутробное инфицирование плода по триместрам развития беременности
Общие положения
Всегда ли нужно лечить выявленную урогенитальную инфекцию, особенно в I триместре беременности? От чего зависит проникновение инфекции к плоду и в какие сроки беременности это наиболее вероятно? Каковы результаты терапии в различные триместры беременности?
Возрастание значимости внутриутробных инфекций в перинатологии связано с появлением более информативных методов диагностики и расширением спектра изучаемых возбудителей. С другой стороны, истинное увеличение частоты этой патологии может быть обусловлено возрастанием инфицированности женщин репродуктивного возраста.
Внутриматочная инфекция является причиной широкого спектра антенатальной патологии: инфекционных заболеваний плода, фетоплацентарной недостаточности, мертворождений, невынашивания, задержки роста плода и аномалий его развития.
Наряду с острым течением инфекции у плода и новорожденного может наблюдаться длительная персистенция возбудителя с формированием латентного, медленнотекущего хронического инфекционного процесса. Инфекционная патология плода часто скрывается за такими диагнозами, как внутриутробная гипоксия, асфиксия, внутричерепная травма новорожденного.
Согласно современным исследованиям, инфекционные заболевания выявляют у 50—60 % госпитализированных доношенных и у 70 % недоношенных детей. По результатам вскрытий новорожденных, у 37,5 % инфекционная патология явилась основной причиной смерти, сопутствовала или осложняла течение основного заболевания.
При многолетнем изучении внутриутробных инфекций выявлено особое своеобразие этой патологии. К сожалению, до настоящего времени мы не имеем достоверных представлений об истинной распространенности перинатальных инфекций, равно как и о вероятности заражения и заболевания плода от инфицированной матери.
Заключения о частоте той или иной инфекционной перинатальной патологии выносят ретроспективно, на основании материалов о выявлении больных детей. Тотального скрининга на перинатально значимые инфекции нет ни в одной стране мира. В результате не учитываются случаи, когда у инфицированных матерей родились здоровые дети. Искажению показателей инфицированности, заболеваемости, риска вертикальной передачи возбудителей способствует и отсутствие микробиологического мониторинга всех плодов при прерванной беременности, обязательного микробиологического изучения тканей мертворожденных детей, плацент во всех случаях преждевременных, осложненных родов, завершившихся рождением больного, слабого или маловесного ребенка.
Многие инфекционно-воспалительные заболевания во время беременности имеют общие черты.
- Инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности.
- Большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме.
- Активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, ОРВИ, переохлаждение и др.).
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Диагноз внутриутробного инфицирования у новорожденного устанавливают на основании выделения возбудителя из клеток крови, спинномозговой жидкости и других источников, выявления антител IgM и низкоактивных антител IgG на патоген в пуповинной крови.
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания.
Под внутриутробной инфекцией подразумевают процесс распространения инфекционных агентов в организме плода и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни, возникшей анте- или интранатально и выявляемой пренатально или после рождения.
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии, грибы, простейшие, микоплазмы, хламидии, вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция.
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- острые инфекции во время беременности;
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности и активация персистирующей хронической инфекции;
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при наличии инфекционных очагов у матери;
- сексуальная активность в сочетании с истмико-цервикальной недостаточностью (ИЦН);
- инвазивные вмешательства во время беременности при наличии инфекции в материнском организме;
- нарушение целостности плодных оболочек;
- эпидемические особенности инфекционного агента (многие вирусы чрезвычайно распространены в популяции, проникнув однажды, они навечно остаются в тканях);
- наличие вторичного иммунодефицита (сахарный диабет, аутоиммунные заболевания, недоразвитие лимфатической системы, микозы).
Следует подчеркнуть, что иммунная система человека тесно связана с функциональной активностью нервной, эндокринной систем и системы гемостаза.
Слаженность и интегрированность взаимодействия систем регуляции способны обеспечить сохранение гомеостаза при любом повреждающем воздействии во время беременности, в том числе и инфекционно-токсическом.
Патогенетические механизмы возникновения, развития и воздействия внутриутробной инфекции разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз хуже);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, толерантности иммунной системы в борьбе с инфекцией.
Пути проникновения инфекции от матери к плоду. Источником внутриутробного инфицирования плода всегда является его мать. Основными путями проникновения и распространения инфекционного агента являются:
- восходящий;
- нисходящий;
- гематогенный.
Особенностью восходящей инфекции является экссудативная форма воспалительной реакции.
В I триместре беременности восходящая инфекция может вызвать острый или латентный эндомиометрит, но не проникнуть к плодному яйцу. Клинико-ультразвуковыми признаками восходящей инфекции в ранние сроки беременности являются симптомы угрозы самопроизвольного выкидыша (боли внизу живота, усиление воспалительных выделений из шейки матки), а также локальное повышение тонуса матки и признаки локальной отслойки хориона (по данным УЗИ). На фоне базального эндомиометрита беременность может прогрессировать. В ряде случаев плодное яйцо подвергается иммунному отторжению и беременность становится неразвивающейся.
С началом II триместра беременности механизм воздействия восходящей инфекции меняется из-за слияния decidua vera и decidua capsularis в единый комплекс (decidua parietalis) и тесного соединения с децидуальной оболочкой. Полость матки становится полостью плодного пузыря. Восходящая инфекция с 14—16 нед беременности может непосредственно проникнуть к плоду из влагалища и из шеечного канала. При этом распространителем и источником инфекции могут быть сперматозоиды.
С этого срока беременности внутренний зев шеечного канала матки соприкасается с амнионом плода. Со И—III триместров беременности, когда внутренний зев шейки матки постепенно приоткрывается, а также при угрозе преждевременного прерывания беременности или при ИЦН возникает реальная угроза проникновения инфекции через плодные оболочки в околоплодные воды (трансмембранное обсеменение околоплодных вод). Околоплодные воды обладают слабым защитным действием. Они только задерживают рост микроорганизмов (но не вирусов) и могут явиться средой накопления инфекционных возбудителей. Плод заглатывает инфицированные околоплодные воды или даже аспирирует их, что приводит к заболеванию, задержке роста и внутриутробным порокам развития, хронической гипоксии, а в тяжелых случаях — к смерти.
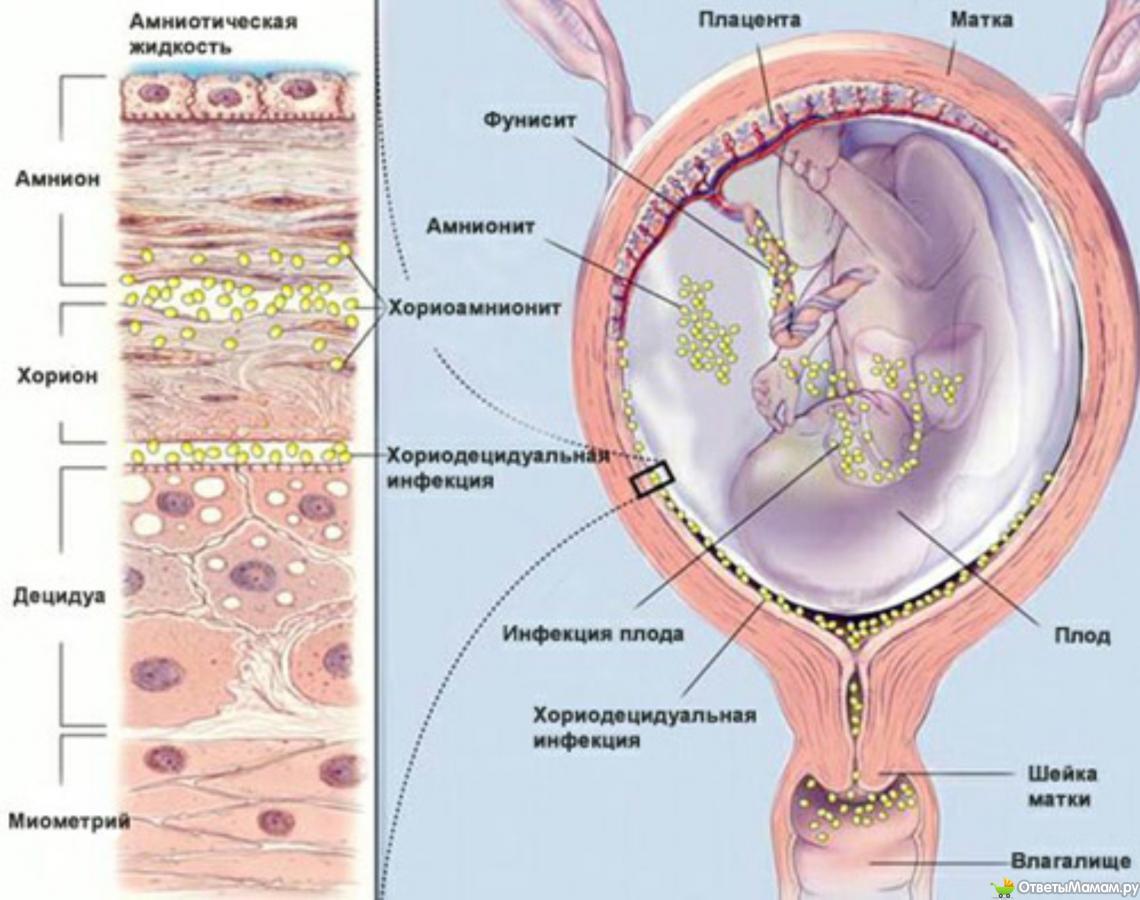
При восходящей инфекции и массивном обсеменении последовательно возникают мембранит, хорионамнионит, фуникулит, инфицирование плода. Симптомом экссудативного мембранита является многоводие, которое отражает наличие воспалительной реакции в амнионе плода.
Таким образом, непосредственными источниками восходящей инфекции служат инфекционные агенты во влагалище, в шеечном канале матки, воспалительные процессы в нижних половых путях (кольпит, цервицит), а также сперматозоиды, несущие инфекцию от сексуального партнера. Способствующими условиями для распространения инфекта являются сексуальная активность во время беременности (незащищенный секс), ИЦН, снижение местного иммунитета и общей иммунологической толерантности (прием глюкокортикостероидов, наличие длительной персистирующей инфекции, анемия, плохое питание).
- Нисходящий путь внутриутробного инфицирования. Нисходящий путь проникновения инфекции от матери к плоду происходит при наличии воспалительного очага в брюшной полости (хронический аппендицит, холецистит) или в придатках матки (аднексит, сактосальпинкс, абсцесс яичника). Через маточные трубы бактерии проникают в полость матки, вызывая тотальное воспаление тканей матери, плаценты и плода.
- Гематогенный путь внутриутробного инфицирования. Абсолютным условием этого пути распространения инфекции является наличие в крови материнского организма большого количества инфекционных возбудителей (бактериемия, вирусемия, паразитемия).
Последовательно возникает воспаление тканей матки и децидуит, вовлечение сосудов системы микроциркуляции (интервиллизит), далее воспаление от плодных оболочек (децидуит, мембранит) и генерализация инфекции у плода (сепсис, менингит).
Гематогенные воспалительные реакции отличаются пролиферативными процессами, которые сопровождаются воспалением стромы ворсин хориона и самой плаценты (плацентит).
Таким образом, инфекция проникает от матери к плоду через сосуды и кровь, вызывая самые тяжелые, генерализованные формы поражения плода, которые чаще всего несовместимы с жизнью или вызывают тяжелейшие заболевания, при которых ребенок становится инвалидом с детства (менингит, энцефалит, сепсис).
Особенности инфекционного процесса и внутриутробного инфицирования плода во время беременности. Особенности инфекционного процесса во время беременности следующие.
- Преобладание микробных ассоциаций. Чаще всего это сочетанные бактериально-вирусные инфекции и очень редко — моноинфекционный процесс.
- Бессимптомное или малосимптомное течение инфекции у матери.
- Сочетание вагинальной и уретральной инфекции, которые объединяют и трактуют как урогенитальную.
- Частое развитие инфекции на фоне бактериального вагиноза.
- Непредсказуемость исхода для плода, новорожденного и для матери: рождение практически здорового ребенка, наличие у новорожденного тяжелых пороков развития, преждевременное прерывание беременности, признаки незрелости плода, различные внутриутробные заболевания и повреждения.
Особенности развития инфекционного процесса у плода
Напомним, что I триместр беременности — это период эмбриогенеза и плацентации. В свою очередь в нем выделяют первые 3 нед — бластогенез, 4—8 нед — эмбриогенез и 9—12 нед — ранний фетальный период развития.
Проникновение бактериальной инфекции через внутренний зев вызывает либо острое воспаление матки (эндомиометрит), повышение тонуса миометрия и самопроизвольный выкидыш, либо не повреждает плодное яйцо, эмбрион и «ранний плод». Дело в том, что до 14 нед срока гестации у плода отсутствуют структуры взаимодействия с инфекционным агентом. Плод не реагирует на инфекционные антигены, так как у него отсутствуют иммунокомпетентные клетки, иммуноглобулины, реакции преципитации, агглютинации и комплементзависимого лизиса микробных тел. И хотя лимфоциты появляются у плода рано — к концу эмбриогенеза (8—9 нед гестации), они не взаимодействуют с бактериальной инфекцией. Их задача в этом периоде развития — уничтожить лимфоциты матери, которые проникли к эмбриону, а также чужеродные клетки отцовского гаплотипа. Так, известно, что возбудитель сифилиса (Treponema pallidum) может проникнуть к плоду и вызвать его заражение только начиная со II триместра беременности.
Исключение составляют вирусы. Они довольно легко проникают через все барьеры к плодному яйцу, эмбриону, плоду и внедряются первоначально в цитоплазму, а далее в геном ядра клетки. В зависимости от срока развития плода, массивности обсеменения они вызывают либо губительный эффект (неразвивающаяся беременность), либо тератогенное и эмбриотоксическое повреждение плода.
С началом плодового периода (9—12 нед беременности) появляются первые органы защиты от инфекции:
- вилочковая железа, продуцирующая Т- и В-лимфоциты;
- очаги кроветворения в печени и почках.
Но они еще не способны взаимодействовать с инфекцией. Ведущую роль в защите и сохранении беременности играют барьерные механизмы: слизистые оболочки половых путей и их секреторная деятельность, сомкнутый маточный зев, слизистая пробка в шейке матки, местный иммунитет материнского организма, а также интерфероны и продукция иммуноглобулинов класса G.
Ведущую роль в проникновении инфекции в полость матки играет восходящий путь инфицирования. Когда имеет место накопление бактерий (колонизация), они преодолевают защитные барьеры путем прилипания к клеткам слизистой оболочки влагалища и мочеиспускательного канала. Реснички бактерий и адгезивные молекулы взаимодействуют с рецепторами уроэпителиальных клеток, размножаются и проникают глубоко в ткани влагалища, мочеиспускательного и шеечного каналов. При этом многие виды бактерий и грибов продуцируют протеолитические ферменты (гиалуронидаза, протеаза), растворяющие межклеточные соединения. Образуются пути проникновения инфекта вверх в полость матки.
Наибольшую опасность в ранние сроки беременности представляют вирусы и токсоплазмы.
Большую роль в развитии воспалительной реакции во время беременности играют цитокины.
В ответ на проникновение инфекционного агента, действие микробных токсинов повышается продукция интерлейкинов (ИЛ-1).
Интерлейкин-1 является эндогенным пирогеном, который связывается с соответствующими рецепторами на Т-лимфоцитах и макрофагах. Последние воздействуют на термосенсорные центры переднего гипоталамуса и стимулируют образование простагландинов (ПГЕ2). Сходное действие оказывает и другой цитокин — фактор некроза опухоли (ФНО).
Цитокины активизируют клетки воспалительного ответа, повышают температуру тела, усиливают ток крови и кровоснабжение плодного яйца, способствуют ликвидации инфектов.
В процесс борьбы с инфекцией вовлекаются многие защитные системы материнского организма, которые приводят к экспрессии факторов роста, повышению или снижению процессов апоптоза и пролиферации. Последние имеют огромное значение в сохранении числа клеток, запрограммированных в геноме данного вида.
Смерть эмбриона, плода, внутриутробные пороки развития при инфицировании во время беременности обусловлены избыточной или недостаточной экспрессией факторов роста. Они либо стимулируют либо тормозят рост клеток (пролиферацию), нарушают миграцию и дифференцировку (приобретение специализированного фенотипа) клеток.
Внутриклеточные факторы роста устойчивы к разрушению, но инфекционные агенты могут непосредственно влиять на генетический аппарат клетки.
Некоторые анаэробные бактерии (Clostridium perfringens) способны разрушать клеточные мембраны, другие — активизируют перекисное окисление липидов, третьи — нарушают гомеостаз ионов. Все они оказывают многостороннее действие: повреждает клеточные мембраны, разрушают плазмолемму и белки цитоскелета, истощают запасы АТФ и эндонуклеаз.
Высокоэнергетические фосфаты в форме АТФ необходимы для многих процессов синтеза и расщепления, происходящих в клетке. Все это в конечном этапе приводит либо к некрозу, либо к апоптозу.
Некоторые бактериальные токсины, вирусные белки, компоненты комплемента, так называемые перфорины (вещество из лизированных лимфоцитов), оказывают прямое губительное действие на плазматическую мембрану клеток эмбриона и плода.
Воздействовать на эти процессы (при современном уровне развития науки) не представляется возможным. Поэтому основным направлением в профилактике инфицирования плода в I триместре беременности остается лечение, проводимое до наступления беременности.
Лечебно-профилактические мероприятия в I триместре беременности должны быть направлены на нормализацию микробиоценоза половых путей. Многие лекарственные препараты, в том числе антибиотики, могут оказать повреждающее влияние на эмбрион и плод в период его раннего роста и развития.
Инфицирование плода в I триместре беременности
Клинические и ультразвуковые признаки внутриутробного инфицирования в I триместре беременности следующие.
- Клинико-анамнестическое обследование для выявления урогенитальных заболеваний: кольпит, цистит, уретрит, цервицит, пиелонефрит и др.
- Мазок-соскоб из влагалища, шеечного и мочеиспускательного каналов с последующей микроскопией.
- Использование методов прямой флюоресценции для выявления антигенов и антител и полимеразной цепной реакции (ПЦР) для выявления участков генома микроорганизмов.
- Определение иммуноглобулинов, свидетельствующих либо об остром инфекционном воспалении (IgM), либо о хроническом инфекционном процессе (IgG).
Клинические симптомы угрозы самопроизвольного выкидыша — боли внизу живота, повышение тонуса матки, слизисто-кровянистые выделения из половых путей.
При УЗИ — признаки локального тонуса миометрия и/или локальной отслойки хориона. Изменение округлой или овальной формы плодного яйца (деформация); отсутствие сердцебиения у эмбриона или отсутствие самого эмбриона («пустое» плодное яйцо).
Таким образом, особенности инфекционного процесса и внутриутробного инфицирования плода в I триместре беременности заключаются в следующем.
- Наличие острой или хронической персистирующей инфекции у беременной женщины является фактором риска инфицирования плодного яйца, эмбриона и плода в раннем периоде его развития.
- Наличие инфицирования в I триместре беременности приводит либо к самопроизвольному выкидышу (неразвивающаяся беременность), либо к эмбриотоксическому и тератогенному повреждению плода.
- Симптомами проникновения инфекции в полость матки являются признаки эндомиометрита, частичной отслойки хориона и угрозы выкидыша.
- Инфекционный агент проникает в матку, но далеко не всегда повреждает плодное яйцо, эмбрион и плод.
- Основными механизмами защиты от инфекции со стороны материнского организма являются слизистые оболочки влагалища и шейки матки, а также секреторная деятельность эпителиальных тканей половых путей.
- У плода в I триместре беременности отсутствуют механизмы взаимодействия с инфекционными агентами, поэтому инфицирование происходит редко.
Инфицирование плода во II триместре беременности
Во II триместре беременности (12—14 нед и позже) инфекция чаще всего проникает к плоду восходящим путем через амнион. Характерным признаком воспаления амниона является многоводие.
Гематогенные инфекции возникают редко в связи с тем, что в эти сроки беременности в плаценте увеличивается толщина хориального синцития и клеток Лангханса, препятствующих трансплацентарной проницаемости. Особенностью воспалительной реакции во II триместре беременности является пролиферация, отграничивающая распространение инфекционного процесса в тканях плаценты.
У плода усложняются механизмы защиты от инфекции. К 16-й неделе происходит морфо-функциональное становление иммунной системы плода. Синтезируются антитела (IgG, IgM, IgA, IgF) в клетках печени, селезенке, вилочковой железе, лимфатических узлах.
Иммуноглобулины материнского происхождения проникают через плаценту к плоду. При возникновении острой инфекции плод синтезирует IgM, а плацента выделяет адсорбирующие молекулы, которые фиксируют бактерии, простейшие и частично некоторые вирусы, не давая им проникать в околоплодные воды.
Кроме того, плацента синтезирует лизоцим, интерферон, цитокины. С 16-й недели гестации в печень плода продуцируется комплемент С2, С4.
С 20-й недели гестации у плода функционирует свой собственный клеточный и гуморальный иммунитет. В ответ на воздействие инфекционного агента развивается воспалительная пролиферативная реакция, ограничивающая дальнейшее проникновение инфекции.
До 20 нед внутриутробное инфицирование чаще всего приводит к генерализованному распространению инфекции и смерти плода.
Чем раньше инфицирован плод, тем его прогноз более неблагоприятен.
В подавляющем большинстве случаев возбудители инфекции проникают в плаценту, иногда даже вызывают воспалительную реакцию (плацентит), но далее к плоду не проходят, что свидетельствует о сильной защитной функции плаценты.
Снижение иммунологической защиты и/или отсутствие неспецифической резистентности к инфекции в материнском организме (стресс, переохлаждение, ОРВИ) могут вызвать генерализию воспалительного процесса в плаценте (плацентит, децидуит) и внутриутробное инфицирование плода.
Признаками внутриутробных инфекций плода являются:
- ЗВУР;
- многоводие;
- увеличение размеров живота (увеличение печени);
- локальные признаки повреждения отдельных органов (кисты, кальцификаты).
Ультразвуковые признаки воспаления плаценты:
- увеличение ее толщины;
- запоздалое созревание, не соответствующее гестационному сроку.
II триместр беременности является наиболее важным для диагностики больших и малых пороков развития у плода, которые часто обусловлены инфекцией.
Особо отрицательную роль для плода играет нейроинфекция. Внутриутробное инфекционное повреждение ЦНС во II и III триместрах определяет значительное число случаев умственной отсталости, задержки психомоторного развития и детской инвалидности. Инфекционное внутриутробное поражение ЦНС в эти сроки редко является причиной смерти плода или новорожденного, но способно существенно тормозить физическое и психомоторное развитие ребенка.
Нейроинфекция представлена тремя основными формами: энцефалит, воспаление оболочек (менингит), вентрикулит, а также их комбинации.
Внутриутробное поражение инфекцией ЦНС плода сопровождается различными тяжелыми структурными нарушениями в формировании мозга (гидроцефалия, субэпендимальные кисты, кистозная дегенерация вещества мозга, или порэнцефалические кисты, аномалии развития коры большого мозга, микроцефалия). Наличие кальцификатов в тканях мозга однозначно свидетельствует о предшествующем инфекционном некрозе. Пренатальное выявление нейроинфекции возможно при использовании мультиплоскостной методики сканирования, которая по своим возможностям не уступает постнатальному ультразвуковому исследованию мозга. Общепринятые горизонтальные плоскости сканирования головки у плода не позволяют оценить или провести сравнение эхогенности различных частей мозговых структур.
С помощью УЗИ возможно выявление признаков вентрикулита (деформация сосудистого сплетения, неоднородность или удвоение отражения от эпендимы желудочков). Повышение эхогенности, особенно локальное, в некоторых отделах полушарий большого мозга, в том числе перивентрикулярных, как правило, обусловлено энцефалитом.
Воспаление мозговых оболочек (менингит) не имеет четких эхографических признаков. Диагностика данного типа нейроинфекции при помощи ультразвука малоинформативна.
В последние годы появились сообщения о связи нейроинфекции с так называемой лентикулостриатной васкулопатией.
Эхографическая картина такой васкулопатии характеризуется наличием линейных гиперэхогенных структур в области чечевицеобразного ядра, которые представляют собой скопление солей вдоль сосудистой стенки артерий, кровоснабжающих базальные узлы. В дальнейшем развиваются локальные повреждения отдельных областей мозга.
Ультразвуковая диагностика возможна не только вирусных, но и бактериальных нейроинфекции. Эти виды инфекций чаще проявляются у детей грудного возраста. Основным эхографическим признаком подобных вариантов нейроинфекции является выраженная гидроцефалия (чаще из-за стеноза водопровода мозга) в сочетании с выраженными изменениями в строении сосудистого сплетения и повышением эхогенности отражения от эпендимы. Наряду с этим могут наблюдаться очаги высокой эхогенности в веществе полушарий большого мозга любой локализации (как проявление энцефалита).
Таким образом, особенности развития инфекционного процесса и внутриутробного инфицирования плода во II триместре беременности следующие.
- Больший риск проникновения инфекционного агента восходящим путем от матери к плоду, минуя децидуальную оболочку матки, но повреждая амнион и хориальную оболочку плода.
- Частым признаком воспаления плодных оболочек является многоводие.
- При проникновении инфекции к плоду возникает генерализация заболевания и особо тяжелые повреждения структур мозга (менингит, энцефалит, гидроцефалия, кисты мозга).
- Обнаружение IgM в крови плода свидетельствует об инфицировании плода, так как иммуноглобулины этого класса материнского происхождения не проникают через плацентарный барьер.
Инфицирование плода в III триместре беременности
Источником инфицирования для плода всегда является мать. У плода нет своей микрофлоры и его иммунокомпетентные клетки впервые сталкиваются с патогенной и условно-патогенной флорой, которая проникает различными путями из организма матери к клеткам фетальной зоны плаценты, оболочкам, в околоплодные воды.
Инфекционный агент контактирует только с механизмами защиты. В ответ на действие инфекционного агента у плода в позднем периоде внутриутробного развития возникают все признаки воспалительной реакции в сочетании с дистрофическими процессами. У инфицированного плода снижаются адаптационные и компенсаторные реакции в ответ на уменьшение маточно-плацентарного и плодово-плацентарного кровоснабжения.
В III триместре развития плод чаще всего инфицируется, заглатывая инфицированные околоплодные воды, или при непосредственном контакте с инфицированными тканями родовых путей в процессе прохождения по родовым путям матери.
Иммунная система плода способна в определенной степени отграничивать распространение инфекции путем развития пролиферативных и экссудативных процессов.
Чаще развиваются не генерализованные инфекционные реакции, а локальные (энцефалит, гепатит, пневмония).
Наличие дисэмбриогенетических стигм у новорожденного свидетельствует о длительно персистирующей в организме плода инфекции, которая проникла к нему в ранний фетальный период.
Влияние вирусов в III триместре чаще всего проявляется признаками незрелости плода при доношенном сроке беременности.
III триместр беременности характеризуется большей устойчивостью плода к инфицированию. Количество IgG, синтезируемых материнским организмом и плацентой, повышается. Увеличивается синтез IgM плодового происхождения. Иммуноглобулины относятся к компонентам иммунитета, биологическая функция которого направлена на распознавание чужеродных антигенов, специфическое с ними взаимодействие и элиминацию. Кроме того, IgG являются регуляторами клеточных механизмов иммунного ответа. Увеличение количества иммуноглобулинов, несомненно, повышает защитный характер иммунной системы.
Инфекция, проникнув в матку, плаценту, оболочки, способна ускользать от иммунного надзора материнского организма. Инфекционные агенты могут подавлять продукцию интерферона и цитокинов, усиливать молекулярную мимикрию. Длительно персистирующая в организме человека инфекция приспосабливается к механизмам иммунной защиты матери. Антигены инфекта могут изменять строение своих рецепторов, приближая их к материнским.
Наибольший риск проникновения инфекции через плаценту имеет место с 32—34-й недели беременности, когда повышается проницаемость плаценты.
Особенно опасна вирусная инфекция, проникающая в головной мозг плода, или штаммы вирусов, обусловливающих нейроинфекцию. Поражая мозг, нейроинфекция вызывает энцефалит, вентрикулит, что впоследствии у ребенка вызывает задержку психомоторного развития, умственную отсталость, смерть.
При ультразвуковой диагностике можно выявить гидроцефалию, деформацию сосудистого сплетения, наличие участков высокой эхогенности в веществе мозга полушарий большого мозга или конгломерат мелких кист в области таламуса.
В начале развития инфекционного процесса в зоне повреждения герминативного матрикса (располагается в зоне субэпендимального слоя) возникает участок некроза, который подвергается в течение 3—4 нед трансформации в кистозную полость.
Предполагают, что время повреждения матрикса наиболее часто происходит в конце II — начале III триместра беременности (26—28 нед).
Герминативный матрикс в эти сроки повреждается на стадии пролиферации клеток, которая обеспечивает формирование серого вещества и глии. Возникают пороки развития головного мозга. До 20 нед гестации герминативный матрикс обладает определенной резистентностью к действию инфекционного агента.
Механизмы защиты плода от инфицирования
Механизмы защиты со стороны материнского организма
Защита плода от инфекции обеспечивается прежде всего факторами неспецифической резистентности и специфического иммунитета со стороны материнского организма.
Это — механические барьеры (слизистая оболочка шейки матки, сомкнутый внутренний зев матки, устья маточных труб, слизистая пробка в шеечном канале), а также биохимические реакции в организме, направленные на подавление инфекционного агента и выведение его из организма. К таким неспецифическим факторам относятся повышение температуры тела, увеличение содержания в крови кортикостероидов, увеличение синтеза лизоцима, разрушающего многие виды бактерий.
Важным звеном в элиминации возбудителя инфекции является фагоцитарная система (моноциты, макрофаги, гранулоциты). Эти клетки осуществляют свою функцию без участия иммунных механизмов, но могут инициировать и специфический иммунный ответ.
Фагоциты продуцируют лимфокины (интерлейкины, интерфероны, лейкотриены).
Защитными факторами от проникновения инфекции через плаценту является система гемостаза. В участках инфицирования плаценты возникают стаз крови, микротромбоз, отложение фибриноида, ограничивающие дальнейшее распространение инфекционного агента.
После активного фагоцитоза клетки, участвующие в этом процессе, на несколько часов становятся неактивными, теряют способность распознавать и связывать инфекцию. В случаях массивного инфицирования в этот период рефрактерности возникает прорыв инфекции к плоду.
В случаях гиперактивности клеток фагоцитарной системы, что может иметь место при реактивации инфекции, повторном остром инфицировании, значительно повышается продукция цитокинов, способных усиливать воспалительный процесс, запускать продукцию активных метаболитов кислорода и каскад свободнорадикальных превращений.
При вирусной инфекции активизируются киллерные клетки, которые лизируют бактериальные и вирусные инфекты. Так устраняются инфекционные агенты вируса кори, гриппа, гепатита, грибов, простейших. Если фагоцитоз оказывается малоэффективным, синтезируются интерлейкины, ФНО, которые являются полифункциональными лимфокинами, а также лейкотриены, белки острой фазы, γ-интерфероны, простагландины.
Специфические иммунные механизмы еще более сложные, так как вовлекают в защитный процесс не только систему иммунитета, но и нейроэндокринную и гемокоагуляционную системы.
Клеточный иммунитет во время беременности существенно снижается, но гуморальный сохраняет свою противоинфекционную защиту. При поступлении инфекционного микроорганизма противоинфекционная защита у беременной женщины происходит по гуморальному типу: продуцируются специфические антитела и эффекторные медиаторы, комплементзависимое усиление фагоцитоза и комплементзависимый лизис вирусов и бактерий.
Когда вирус внедряется в геном клетки и реплицируется, на первое место выходят клеточные иммунные реакции с участием Т-лимфоцитов. Нередко вирусная инфекция из острой переходит в персистирующую. Между вирусом и иммунной защитой хозяина устанавливается определенное равновесие, которое клинически никак не проявляется. В этих случаях, несмотря на наличие инфекции в организме матери и признаки инфицирования плаценты, околоплодных вод, ребенок может родиться здоровым без реализации этой инфекции.
Большое значение имеет иммунная система плода. Ее образование и функциональное становление растянуто во времени, поэтому разберем этот процесс.
В децидуальной оболочке матки во время беременности преобладают Т-супрессоры (CD8) над Т-хелперами (CD4). Их соотношение примерно пропорции 3:1. Клетки децидуальной оболочки помогают дифференцировке трофобласта, защищают плод от проникновения инфекции путем локальных отграничительных реакций. Даже наличие хронического базального эндомиометрия не сопровождается 100 % инфицированием плода.
Плацента является самой мощной преградой на пути проникновения инфекции от матери к плоду. Независимо от характера возбудителя изменения в плаценте принципиально однотипны. При плацентите прежде всего имеет место поражение стенок сосудов (утолщение, сужение просвета, облитерация) и активация коагуляционного звена гемостаза (тромбоз). Характерным признаком воспаления ткани плаценты является лимфоидная, плазматическая и лейкоцитарная инфильтрация, которая в основном распространяется на якорные ворсины. Последнее обстоятельство еще раз доказывает, что ложное или истинное приращение плаценты является следствием воспалительного процесса матки и материнской части плаценты.
При длительно персистирующей инфекции в плаценте имеет место большая распространенность инфекционного процесса, захватывающая материнскую и плодовую части, межворсинчатые пространства, а также сосуды (развитие склеротических и дистрофических изменений). Признаки инфицирования последа наблюдаются часто, но большей частью инфекция не проникает к плоду, а если и проникает, то уничтожается с помощью иммуноглобулинов материнского происхождения (IgG) и иммунной системой плода. Напомним, что действие IgM плодового генеза в сотни раз более активное, чем IgG.
Плацентит всегда сопровождается нарушением кровотока в системе мать — плацента, но не всегда — плацента — плод. По-видимому, играют роль выраженные компенсаторные приспособительные реакции в плаценте, усиленная васкуляризация ворсин, дополнительное развитие капилляров, активный процесс неоангиогенеза.
В самых тяжелых случаях, когда новорожденные дети рождаются с признаками внутриутробного инфицирования и даже антенатальной смерти плода, в плаценте обнаруживают изменения, которые оцениваются как хроническая субкомпенсированная и даже компенсированная плацентарная недостаточность, обусловленные в основном высоким содержанием бессосудистых ворсин, в среднем до 50 %, по данным В. А. Цизерлина и В. Ф. Мельниковой (2002).
Механизмы защиты со стороны плода (становление иммунной системы плода)
В период эмбриогенеза (3—8 нед) происходит закладка, рост и развитие всех органов плода, в том числе и клеток иммунной системы. В 5 нед гестации образуется вилочковая железа, которая станет центральным органом иммунной системы. Одновременно формируются печень, селезенка, лимфатические скопления по ходу сосудов. Из одной стволовой гемопоэтической полипотентной клетки с 3-й недели развития в желточном мешке, а в 5 нед в печени эмбриона дифференцируются лимфоциты, тромбоциты, гранулоциты и моноциты. Клетки сразу начинают мигрировать в кровь, органы, ткани эмбриона, так как обладают свойствами помогать дифференцировке, пролиферации и апоптозу. Часть лимфоцитов мигрирует в вилочковую железу, где происходит их дальнейшее созревание до Т-лимфоцитов. Другая часть лимфоцитов проникает в костный мозг и созревает там до В-лимфоцитов.
Процесс созревания заключается в том, что на мембране Т- и В-лимфоцитов появляется один рецептор главного комплекса совместимости. Появление этого рецептора позволяет клеткам узнавать друг друга и взаимодействовать с окружающими клетками, вступая в молекулярные реакции.
Далее происходит отбор таких лимфоцитов, которые не только узнают собственные антигены, но и начинают различать чужие. В эмбриональном периоде клетки иммунной системы первоначально не вступают в контакт с чужими антигенами, и только когда на лимфоцитах экспрессируются рецепторы, распознающие не только свой главный комплекс гистосовместимости, но и чужие антигены, иммунная система плода способна бороться с инфекцией (это происходит в среднефетальном и позднефетальном периодах развития).
На 13—14-й гестационной неделе развития вилочковую железу заселяют незрелые лимфоциты. В течение 6—7 нед происходит их созревание, которое заключается в том, что на мембране Т-лимфоцитов образуются рецепторы — антигенные маркеры, объединенные в кластеры дифференцировки. Набор различных кластеров на поверхности каждого лимфоцита (каждой клетки) и составляет фенотип.
Зрелые Т-лимфоциты расселяются по периферической лимфатической системе (лимфатические узлы, селезенка, зоны вдоль сосудов), и к 20—22-й неделе развития происходит полная антигензависимая дифференцировка иммунокомпетентных клеток. Наличие специальных рецепторов на мембране иммунокомпетентных клеток приводит к появлению клонов Т-лимфоцитов, способных на иммунный ответ.
Каждый клон Т-лимфоцитов программируется на реализацию конкретной задачи.
К 22-й неделе гестации (масса тела плода не менее 500 г) происходит интеграция взаимодействия иммунной и нейроэндокринной систем, которые объединяют также систему гемостаза. Формируется единая система регуляции.
Период становления иммунной системы плода (14—22 нед гестации) называется антигензависимой дифференцировкой. Когда Т-лимфоциты «научились» распознавать чужеродные антигены, плод способен бороться с инфекцией.
Зрелые Т-лимфоциты (плодовый период развития) в отличие от незрелых (эмбриональный возраст) имеют на своей поверхности белок либо CD4+, либо CD8+, но не оба. CD4+ — это аналог Т-лимфоцитов-хелперов, которые повышают силу иммунного ответа, CD8+ — Т-лимфоциты-супрессоры, снижающие его.
От соотношения CD4+ и CD8+ зависят реакции организма плода в ответ на внедрение инфекционного агента и эффективность защиты.
Если по неизвестным причинам нарушается соотношение CD4+ и CD8+ в пользу продукции Т-супрессоров (CD8+), то такой дисбаланс в иммунорегуляторных субпопуляциях является причиной повышенной чувствительности к оппортунистической инфекции, которая может вызвать внутриутробное инфицирование плода.
Следует еще раз подчеркнуть, что у плода нет своей микрофлоры, его органы и ткани стерильны. Источником инфекции для плода всегда является мать. Ее флора во влагалище и шейке матки, массивность обсеменения, состояние барьерных тканей, неспецифическая резистентность и специфический иммунитет определяют риск проникновения инфекции в плаценту и далее к плоду.
На вопрос, нужно ли лечить беременную женщину от имеющейся у нее инфекции, ответ может быть однозначным — лечить. Срок применения антибактериальных, антивирусных и других лекарственных средств должен определяться II и III триместрами беременности, чтобы не вызвать ятрогенного повреждения плода в период его эмбриогенеза. Тем более что эмбрион практически не реагирует на инфекционный агент (нет механизмов взаимодействия) либо умирает. Лекарства в этот период его спасти не могут.
В процессе дальнейшего развития плода (среднефетального) Т-лимфоциты-хелперы, несущие гликопротеид CD4+, дифференцируются на отдельные популяции; одни из них продуцируют γ-интерферон, интерлейкин, ФНО, активирующие макрофаги, клетки-киллеры, что обеспечивает развитие клеточного иммунитета. Другая популяция отвечает за формирование гуморального звена иммунной системы. Эта популяция в ответ на проникновение инфекции в плаценту тотчас же продуцирует IgM.
Супрессорное звено (Т-лимфоциты, несущие гликопротеид CD8+) выполняет цитотоксические функции, и его супрессорный механизм направлен против отцовского гаплотипа. Основная их функция — надзор за генетическим постоянством клеток. Если появляются антигены с чужеродным гаплотипом, формируется клон клеток CD8+, лизирующие их.
Наиболее опасными для плода являются вирусы, которые проникают через все биологические барьеры, в том числе через плаценту и плодные оболочки. С вирусами плод борется всеми своими силами и далеко не всегда безуспешно. Как только в организме плода появились вирусинфицированные клетки, Тх (CD4+) и Тс (CD8+) распознают чужеродный антиген и синтезируют клоны своих клеток для его уничтожения. Продуцируется интерлейкиновый каскад, который приводит к образованию клеток-киллеров, выделяющих специфические антитела. Активизируется апоптоз (запрограммированная смерть вирусинфицированных клеток) путем разрушения и фрагментации ядра без повреждения мембраны с последующим фагоцитозом макрофагами.
В-лимфоциты, заселяющие костный мозг, селезенку, печень, лимфоидные фолликулы кишечника, в среднефетальном периоде развития плода так же, как и Т-лимфоциты проходят стадию созревания. В эмбриогенезе они не могут распознавать чужеродные антигены, поскольку имеют только один рецептор, узнающий гаплотип (т. е. свои антигены).
В раннем и среднефетальном периодах развития на мембранах В-лимфоцитов образуются антиген-распознающие рецепторы типа IgM. Интересно, что эти рецепторы могут исчезать с поверхности В-лимфоцита и циркулировать в крови плода. При появлении чужеродных антигенов инфекции IgM первыми контактируют с ними, распознают их, выставляют на своей мембране их данные и активируют фагоцитоз, клон специфических плазматических клеток, передают информацию об опасности всем иммунокомпетентным клеткам и вилочковой железе. Недостатком иммунного ответа В-лимфоцитов является продукция только одного клона IgM, но зато они являются линией первой защиты. После своего действия активность В-лимфоцитов снижается, и они быстро погибают. Но к этому времени Т-лимфоциты переключаются на синтез IgG, IgE, IgA. Их продукция, особенно IgG, делает иммунную защиту более сильной, разнообразной и эффективной.
Остановимся на краткой характеристике иммуноглобулинов.
Иммуноглобулин класса М. Антитела класса IgM продуцируются плодом сразу, как только появился чужеродный антиген инфекции, поэтому они относятся к ранним. Из-за крупных размеров своей молекулы они не переходят через плаценту, но могут синтезироваться клетками плаценты. Обнаружение IgM свидетельствует об остром инфицировании плода. У IgM нет рецепторов иммунологической памяти. Каждая встреча с инфекционным агентом сопровождается новой волной стимуляции образования IgM. Агглютинирующая и комплементсвязывающая способность IgM в сотни раз активнее, чем у IgG.
Иммуноглобулин класса G. Синтезируется иммунной системой матери, легко переходит через плацентарный барьер к плоду, однако при проникновении инфекционного агента в плаценту и к плоду синтезируется их клетками. Является основным антителом вторичного иммунного ответа. Обладает способностью иммунологической памяти. Основная функция IgG — защита от инфекции и их токсинов. Продуцируются Т-лимфоцитами, представляют наиболее многочисленный класс иммуноглобулинов.
Иммуноглобулин класса А. Существует в двух формах — сывороточной и секреторной. Продуцируется при попадании инфекции в желудочно-кишечный тракт, легкие, бронхи, мочеполовые пути. Много IgA в грудном молоке, особенно молозиве. Поступление IgA предупреждает раннее заселение кишечника новорожденного грамотрицательными бактериями (Е. coli), способствует формированию грамположительной флоры, которая является антагонистом возбудителей кишечных инфекций. IgA связывает микроорганизмы и предотвращает их прикрепление к слизистой оболочке кишечника.
Иммуноглобулин класса Е. Продуцируется плазматическими клетками селезенки, миндалин, слизистых оболочек дыхательных путей, желудка и кишечника. Продукция IgE у плода начинается рано, представляет одну из линий защиты слизистых оболочек, контактирующих с окружающей средой. Для плода — это околоплодные воды и амнион. Если инфекция все же прорывает эту линию защиты, из тканей высвобождаются IgE, базофилы, эозинофилы, лейкоциты и плазматические клетки.
Иммуноглобулин класса D. Не связывает комплемент, не проходит через плаценту. Играет роль антигенраспознающего рецептора В-лимфоцитов. В значительной степени его функции неизвестны.
Противовирусным эффектом обладают интерфероны, которые разрушают вирусную РНК, подавляют синтез вирусной матричной РНК и синтез белков вирусной оболочки.
К сроку рождения плода иммунная система полностью дифференцирована. Иммунокомпетентные клетки имеют необходимое количество рецепторов, характеризующих фенотип организма, а также рецепторов, способных распознавать инфекционный геном. Регуляторная система и органы плода (надпочечники, мозг) продуцируют кортикотропины, эндорфины, энкефалины в ответ на ухудшение кровоснабжения или снижение кислорода.
Обнаружено, что лимфоциты (Т-популяция) и мембраны нейронов головного мозга имеют идентичные рецепторы для вазопрессина, эндорфинов, некоторых гормонов (инсулин, тиротоксин, соматотропин), цитокинов, нейропептидов. Иммунная система и ЦНС в процессе роста, развития, жизнедеятельности плода постоянно обмениваются информацией и корригируют свои взаимодействия.
Неблагоприятные условия развития плода (уменьшение кровоснабжения, гипоксия, инфицирование) снижают активность иммунологической защиты. После непродолжительного периода усиленной адаптации и компенсации наступают дезадаптация, истощение и формирование врожденной неполноценности систем регуляции.
В настоящее время доказано, что врожденный первичный иммунодефицит у ребенка чаще всего обусловлен генетическими дефектами в различных звеньях иммунитета. Однако следует, по-видимому, изучать роль других факторов, например роль столь часто применяемых сегодня во время беременности кортикостероидов, синтетических гестагенов, повреждающее воздействие на плод лекарственных средств, преждевременно стимулирующих функции поджелудочной, щитовидной и вилочковой желез.
С 22-й недели гестации вплоть до окончания внутриутробного периода развития плода иммунная, нервная и эндокринная системы объединены в единую всепроникающую регуляторную систему, которая способна распознать, запомнить, извлечь информацию, определить ответные реакции. Именно поэтому с 22-й недели гестации плод способен к внеутробному существованию в условиях, приближенных к гомео-статическим условиям внутриутробной среды.
В предупреждении проникновения и распространения инфекции к плаценте и плоду важную роль играет организм матери. Депрессия, отрицательные эмоции, плохое питание, напряженная трудовая деятельность, хронические заболевания и очаги инфекции сопряжены со вторичным иммунодефицитным состоянием. Доказано, что на пике острого стресса в периферической крови кратковременно исчезают все иммуноглобулины. При вторичном иммунодефиците снижается не только общая сопротивляемость, но и гуморальный и клеточный иммунитет. Именно тогда условно-патогенная флора может стать источником внутриутробного инфицирования и заболевания плода. Присоединение гестоза обычно способствует распространению инфекции, так как при этом осложнении беременности повышается проницаемость плацентарного барьера.
Методы исследования на наличие инфекции во время беременности
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика ее в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-инструментальных методов исследования.
- Клинический метод: клинические признаки при осложненном течении беременности, проявления инфекции у матери.
- Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (фетометрия, поведенческая активность плода, его тонус, количество околоплодных вод, зрелость плаценты);
- допплерография (МПК, ФПК);
- кардиотокография;
- компьютерная кардиоинтервалография.
- Микробиологические и серологические исследования:
- микроскопия (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА) — обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA в диагностически значимых титрах).
- Исследование хориона (биопсия хориона) — культуральный метод, ПЦР-диагностика.
- Исследование околоплодных вод (амниоцентез) — культуральный метод, ПЦР-диагностика.
- Исследование пуповинной крови плода (кордоцентез) — культуральный метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
- Морфологическое исследование плаценты, данные вскрытия.
- Клиническая оценка состояния новорожденного (незрелость при доношенном сроке беременности, манифестация инфекционного заболевания, врожденные пороки развития).
Косвенные методы (определение у матери клиники инфекционного заболевания и специфического иммунного ответа, ультразвуковой метод) помогают установить предположительный диагноз внутриутробного инфицирования.
К прямым методам диагностики внутриутробного инфицирования и инфекции относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, культуральный метод), кордоцентезе (ПЦР, культуральный метод и определение уровня специфических антител IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах развития зародыша (1—3 нед беременности) из-за отсутствия механизмов взаимодействия инфекта и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться алътеративным процессом и гибелью плодного яйца.
Повреждения эмбриона инфекцией на 4— 12-й неделе беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект.
В I триместре специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование ИЦН (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели — происходит генерализация инфекции у плода. Могут возникать такие пороки развития как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии).
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде.
Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- ЗВУР плода;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной пластинки;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит).
Признаки инфекционного процесса подтверждаются также результатами морфологического исследования последа. Проведенные патоморфологические исследования плацент в клинических наблюдениях с подозрением на ВУИ позволяют обнаружить явления патологической незрелости ворсинчатого дерева; гиповаскуляризацию терминальных ворсин, циркуляторные расстройства, инволютивно-дистрофические процессы почти в 100 % наблюдений.
Общие положения по профилактике внутриутробного инфицирования
Профилактика внутриутробной инфекции снижает частоту и тяжесть осложнений беременности, родов, а также неблагоприятных перинатальных исходов.
К профилактическим мероприятиям у пациенток группы риска по развитию ВУИ относятся:
- подготовка к планируемой беременности;
- ограничение сексуальной активности во время беременности (при наличии инфекции у супругов);
- соблюдение личной гигиены;
- ограничение контакта с животными;
- профилактика ФПН;
- своевременное и адекватное лечение инфекционных заболеваний мочеполовой системы с соответствующим контролем эффективности проведенной терапии (II и III триместры беременности);
- повышение активности местного иммунитета.
Для современного клинициста важно учитывать, что ранняя диагностика позволяет своевременно решить вопросы о пролонгировании беременности и проведении необходимой комплексной терапии у беременных с внутриутробной инфекцией. Лечение внутриутробного инфицирования проводить необходимо, но только во II— III триместрах и при:
- наличии выявленных и доказанных признаков инфицирования плода на основании результатов комплексной диагностики;
- выраженном клиническом проявлении инфекции у матери;
- высоком и продолжающем повышаться титре специфических антител (IgM).
Антимикробное и иммунокорригирующее лечение в комплексе с патогенетически направленной терапией ФПН позволяет снизить частоту проявления клинических форм ВУИ и улучшить перинатальные исходы.