Во время беременности возникает новая функциональная система мать — плацента — плод, обусловливающая множество изменений в организме женщины.
Мать и плод взаимно влияют друг на друга через плаценту, которая, с одной стороны, объединяет их, с другой — обеспечивает определенную автономность плоду.
Чаще всего здоровые молодые женщины рождают здоровых детей. Но нельзя окончательно утверждать, что больная женщина может родить только больного ребенка. Полноценная генетическая программа, заложенная в яйцеклетке и сперматозоиде, нормальное развитие плодного яйца, плода и плаценты обеспечивают необходимые условия для рождения здорового ребенка.
Важное значение для нормального развития беременности имеют образ жизни, питание, психологический настрой, отказ от вредных привычек.
Автор: Сидорова.
Роль плаценты. Гормональная и белково-образующая функция плаценты
Все изменения, происходящие в организме женщины во время беременности, носят адаптационный характер и направлены на создание оптимальных условий для развития плода.
С первых недель наступления беременности вплоть до ее окончания формируется структурное и функциональное единство — система мать — плацента — плод. Основой этого единства является плацента, точнее — послед. Послед — это система жизнеобеспечения плода, комплексный орган, в формировании которого принимают участие производные трофобласта и эмбриобласта, а также децидуальная ткань и сосуды матки.
Плацента выполняет целый ряд важнейших функций, направленных на обеспечение достаточных условий для физиологического течения беременности и нормального развития плода. К этим функциям относятся дыхательная, трофическая, выделительная, защитная, эндокринная.
На протяжении 10 лунных месяцев (280 дней) послед проходит весь жизненный цикл развития: зарождение, развитие, функциональный расцвет и старение. При этом все составные компоненты последа неуклонно связаны с развитием и потребностями плода.
Плацента — комплексный провизорный орган, в образовании которого принимают участие ткани матери и плода. Все метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода. И хотя кровь матери и плода не смешивается, так как их разделяет плацентарный барьер, все необходимые питательные вещества и кислород плод получает из крови матери. Основным структурным компонентом плаценты является виллезное дерево, представленное стволовыми ворсинами, незрелыми промежуточными ворсинами, мезенхимальными ворсинами (I—II триместры беременности), а также зрелыми промежуточными и терминальными ворсинами (III триместр беременности).
Следует подчеркнуть, что не только мать и плацента обеспечивают жизнедеятельность плода, но и плод на протяжении всей беременности выделяет факторы роста для развития виллезного дерева плаценты. В начале формирования беременности (эмбриональный период) происходит разрастание и дифференцировка эмбриональных, фетальных сосудов, а потом мезенхимальных ворсин трофобласта. Возрастает перфузионное давление в капиллярах ворсин хориона, что стимулирует плацентарный ангиогенез.
При нормальном развитии беременности имеется корреляционная зависимость между ростом плода, его массой тела и размерами, толщиной, массой плаценты.
До момента образования синцитиокапиллярных мембран (16 нед беременности) развитие плаценты опережает темпы роста плода. В случае смерти эмбриона (плода) происходит торможение роста и развития ворсин хориона и прогрессирование инволюционно-дистрофических процессов в плаценте. Достигнув необходимой зрелости (38—40 нед беременности), в плаценте прекращаются процессы неоангиогенеза, новообразования и созревания ворсин хориона.
Высокая гормональная насыщенность организма матери эстрогенами и прогестероном размягчает соединения костей таза; обеспечивает процессы гипертрофии, гиперплазии, растяжения и сокращения матки; снижает тонус мочеточников и мочевого пузыря.
Необходимо подчеркнуть, что, несмотря на существование раздельных систем кровообращения в матке и в плаценте, которые отделены друг от друга плацентарной мембраной, гемодинамика матки теснейшим образом связана с плодово-плацентарным кровотоком. Поэтому повышение тонуса матки или ухудшение состояния плода вследствие снижения кровотока неизменно влияют друг на друга, что выражается в клинической картине угрожающего преждевременного прерывания беременности. Капилляры хориона пульсируют соответственно сердцебиению плода, оказывая влияние на циркуляцию материнской крови через межворсинчатое пространство.
Гормональной функции плаценты принадлежит ведущая роль в регуляции обменных процессов и специфических изменений в системе мать — плацента — плод для обеспечения адекватных условий сохранения и нормального прогрессирования беременности.
Представление о физиологических механизмах регуляции гестационного процесса является основой для понимания генеза многих форм акушерской патологии и выработки патогенетически обоснованной терапии различных осложнений беременности.
В процессе развития беременности плацента синтезирует практически все известные гормоны женского организма, используя материнские и плодовые предшественники.
Каждый из гормонов, которые продуцируются плацентой, соответствует гипофизарному или гипоталамическому гормону по биологическим и иммунологическим свойствам, а также известным стероидным половым гормонам.
Среди гормонов, аналогичных гипофизарным, плацента вырабатывает:
- хорионический гонадотропин (ХГ);
- плацентарный лактоген (ПЛ);
- хорионический тиреотропин;
- предполагается существование плацентарного кортикотропина.
Кроме того, плацента продуцирует родственные АКТГ пептиды, включая β-эндорфины и α-меланостимулирующий гормон.
К гормонам, которые аналогичны гипоталамическим, относятся:
- гонадотропин-рилизинг-гормон;
- тиреотропин-рилизинг-гормон;
- соматостатин.
Отличие плаценты от других эндокринных органов заключается также и в том, что она продуцирует одновременно различные по своей структуре гормоны — белковой и стероидной природы.
Гормонами белковой природы, которые синтезируются плацентой, являются:
- хорионический гонадотропин;
- плацентарный лактоген;
- пролактин;
- хорионический тиреотропин.
Из стероидных гормонов плацента синтезирует прогестерон и эстрогены (эстрон, эстриол, эстрадиол).
Плацентарные гормоны вырабатываются децидуальной тканью, синцитио- и цитотрофобластом.
До недавнего времени децидуальная и фетальные оболочки не рассматривались как активные эндокринные образования. В настоящее время получены данные о том, что эти структурные элементы синтезируют и метаболизируют ряд гормонов, а также отвечают на гормональные воздействия (судя по наличию в них соответствующих рецепторов). Децидуальная оболочка имеет тесный контакт с плодом через амниотическую полость и подлежащий миометрий и считается зоной взаимного влияния матери и плода посредством гормонов и рецепторов.
Следует подчеркнуть, что плацента в определенной степени является автономным, саморегулирующимся органом, независимым от гипоталамо-гипофизарных регуляторных воздействий. Секреция плацентарных гормонов не управляется механизмами, контролирующими выработку гормонов эндокринными железами.
Хорионический гонадотропин является гликопротеидом, имеет определенное структурное и функциональное сходство с пролактином. ХГ синтезируется главным образом в синцитиотрофобласте, а также в синцитиальных почках и свободных симпластах.
Подобно всем гликопротеидным гормонам ХГ состоит из двух субъединиц: а и (3. Если не считать очень слабых различий, α-субъединица одинакова у всех гликопротеидных гормонов, а (3-субъединица определяет их специфичность.
Начиная с ранних сроков беременности, ХГ выполняет лютеотропную функцию, поддерживая стероидогенез в желтом теле яичниками и способствуя его превращению в желтое тело беременности. Биологическое действие ХГ имитирует активность фолликулостимулирующего гормона (ФСГ) и пролактина, стимулируя функциональную активность желтого тела и непрерывную продукцию прогестерона. В свою очередь прогестерон определяет степень развития деци-дуальной оболочки.
ХГ способствует синтезу эстрогенов в фетоплацентарном комплексе, а также участвует в процессе ароматизации андрогенов плодового происхождения. При этом ХГ регулирует и стимулирует продукцию стероидов у плода, так как с его участием в корковом веществе надпочечников плода секретируется ДГЭА-сульфат, а яички плода мужского пола выделяют тестостерон. Таким образом, ХГ влияет на формирование функциональной активности гонад и надпочечников плода.
Нарастание уровня ХГ, а также синтезируемых желтым телом и плацентой стероидных гормонов приводит к торможению циклической секреции гипофизарных гонадотропных гормонов, что проявляется низким содержанием в крови беременных ФСГ и пролактина.
ХГ способствует торможению иммунологических реакций организма беременной путем индукции супрессорных Т-клеток, препятствуя отторжению плодного яйца. Сегодня ХГ рассматривается как основной иммунодепрессант в предотвращении иммуноконфликта и отторжения плода.
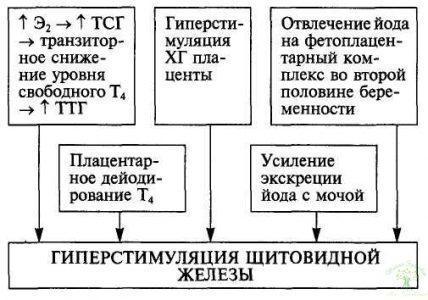
Гормон оказывает также тиреоидстимулирующий эффект, так как в молекуле ХГ обнаружены участки, обеспечивающие взаимодействие с рецепторами тиреотропного гормона (ТТГ).
В ранние сроки беременности экскреция ХГ с мочой отражает гормональную функцию трофобласта. С мочой гормон начинает выделяться со 2-й недели, достигая наивысшего уровня в 10 нед, после чего его концентрация уменьшается и поддерживается на определенном уровне до окончания беременности (с повторным пиком в 32— 34 нед).
Следует подчеркнуть, что методика определения ХГ в моче имеет недостатки из-за низкой чувствительности и малой специфичности, что нередко обусловлено перекрестной реакцией с пролактином. Кроме того, показатели уровня ХГ в моче обладают инертностью во времени, варьируя в достаточно широких индивидуальных пределах. Так, уже при начавшемся самопроизвольном аборте и смерти плода ХГ часто снижается очень медленно и какое-то время может давать положительный результат, свидетельствующий о нормальной гормональной функции.
Следовательно, из-за возможности ложных результатов с диагностической точки зрения определение ХГ в моче может считаться ориентировочным тестом.
ХГ в сыворотке материнской крови выявляется уже на 8—9-й день после зачатия. В I триместре беременности концентрация ХГ повышается очень быстро, удваиваясь каждые 2—3 дня, достигая максимума на 8—10-й неделе беременности. После этого концентрация гормона начинает снижаться и в течение второй половины беременности остается относительно постоянной. Кроме целых, недиссоциированных молекул ХГ, в периферической крови циркулируют также и свободные α- и β-субъединицы гормона. Большинство используемых тест-систем предназначено для определения уровней недиссоциированной молекулы ХГ, что позволяет измерять содержание свободных субъединиц молекулы гормона.
Целесообразно также определять β-субъединицу ХГ в крови беременных. Данный метод обладает более высокой чувствительностью, позволяет избежать диагностических ошибок и дает возможность установить наличие беременности в самые ранние ее сроки. Методика пригодна для диагностики эктопической беременности.
При патологии трофобласта, которая чаще всего сопровождается неразвивающейся беременностью или угрозой ее прерывания, отмечается снижение уровня ХГ.
Повышенное содержание гормона может быть обусловлено наличием многоплодной беременности, патологической пролиферацией клеток трофобласта при пузырном заносе или хромосомными аберрациями у плода.
Плацентарный лактон (хорионический соматомаммотропин) имеет биологическое и иммунологическое сходство с гормоном роста гипофиза (его называют гормоном роста беременных). Название «плацентарный лактоген» гормон получил из-за предполагаемого лактогенного эффекта.
ПЛ способствует стимуляции формирования секреторных отделов молочных желез у беременных. Этот гормон в синергизме с ХГ поддерживает стероидогенез в желтом теле яичника, стимулирует развитие плода (эпифизарный рост костей).
Важная биологическая роль ПЛ заключается в регуляции углеводного и липидного обмена. Гормон стимулирует выделение инсулина, оптимизирует утилизацию глюкозы в организме матери, сберегая ее для плода, способствует накоплению жира, обеспечивает увеличение содержания в плазме свободных жирных кислот, создавая необходимый энергетический резерв.
Считается, что ПЛ относится к метаболическим гормонам, обеспечивающим плод питательными веществами.
Источником энергии для плода являются кетоновые тела, которые образуются из жирных кислот, проникающих через плаценту. Кетогенез также регулируется ПЛ.
Итак, ПЛ регулирует метаболические процессы в организме матери, направленные на мобилизацию энергетических ресурсов для роста и развития плода. Гормон оказывает катаболическое действие, сохраняя адекватное поступление субстратов для метаболических систем плода.
В I триместре беременности основной синтез ПЛ осуществляется вневорсинчатым цитотрофобластом. В более поздние сроки гормон синтезируется синцитиотрофобластом ворсин. Большая часть ПЛ — 90 % — поступает в кровь беременной, а остальные 10 % попадают в околоплодные воды и к плоду.
Гормон определяется в сыворотке крови беременной радиоиммунологическим методом начиная с 5—6-й недели. В связи с увеличением функциональной активности и массы плаценты продукция гормона нарастает и достигает максимальных значений к 36—38 нед, после чего происходит некоторое снижение его концентрации. Действие гормона определяет метаболическую и биосинтетическую функции синцитиотрофобласта.
Колебания индивидуальных показателей ПЛ обусловлены размерами плаценты и массой плода.
Клиническое значение определения уровня ПЛ в сыворотке крови обусловлено тем, что снижение концентрации гормона свидетельствует о нарушении функции плаценты.
Многоплодная беременность приводит к увеличению концентрации гормона пропорционально массе и числу плацент.
При ФПН и нарушении эндокринной функции плаценты падение уровня СМТ как основного метаболического гормона беременности является одним из патогенетических факторов задержки развития плода.
Во второй половине беременности прогностическое значение имеет только низкий уровень ПЛ. Выраженная ФПН, как правило, сопровождается снижением концентрации ПЛ более чем на 50 % по сравнению с нормативными показателями, характерными для данного срока беременности. Об антенатальной смерти плода свидетельствует уменьшение уровня гормона на 80 % и более.
При угрозе прерывания беременности снижение уровня ПЛ является одним из ранних диагностических признаков.
Учитывая, что изменение выработки гормона находится в прямой зависимости от массы плаценты, а также от степени тяжести и длительности осложнения, оценка уровня ПЛ должна быть дифференцированной. Так, при сахарном диабете и при гемолитической болезни плода сопутствующая им макросомия и увеличение массы плаценты маскирует снижение уровня ПЛ, что не отражает истинного состояния фетоплацентарной системы.
Пролактин (лютеотропный гормон, ЛТГ) преимущественно синтезируется в децидуальной оболочке и в передней доле гипофиза. Регуляторные механизмы децидуальной и гипофизарной продукции пролактина различны. Это, в частности, доказывается тем, что дофамин не тормозит продукцию гормона децидуальной оболочкой.
Количество циркулирующего в крови беременных пролактина, который определяется радиоиммунологическим методом, возрастает уже в I триместре (5—6 нед) и ко времени родов в 10 раз превышает исходный уровень.
Основным стимулятором пролактина являются эстрогены.
Структурное сходство пролактина с ПЛ обусловливает его физиологическую роль в регуляции функции молочных желез. Кроме того, пролактин имеет определенное значение в синтезе сурфактанта и в процессе фетоплацентарной осморегуляции, что связано с его воздействием на осмотические процессы в стенке амниона.
Хорионический тиреотропин синтезируется плацентой и является гормоном белкового происхождения. По своим физико-химическим, иммунологическим и гормональным свойствам близок к ТТГ гипофиза. Исходя из этого выявлено, что хорионический тиреотропин поддерживает секрецию тиреоидных гормонов. Тиреоидстимулирующее действие наиболее выражено в ранние сроки беременности, а затем несколько снижается.
Специфическая роль гормона во время беременности полностью еще не изучена. Однако отмечено, что активация функции щитовидной железы (а иногда и гипертиреоз) выявляется при пузырном заносе и других опухолях трофобласта.
Хорионический кортикотропин, синтезируемый трофобластом, обладает кортикотропной активностью. Гормон вызывает резистентность гипофиза к действию глюкокортикостероидов по механизму обратной связи.
Плацента синтезирует также родственные АКТГ пептиды, к которым, в частности, относится β-эндорфиноподобный пептид, аналогичный по действию синтетическому (β-эндорфину. При этом синтез гормона идентичен гипофизарному. Напомним, что в гипофизе синтезируется гормон-предшественник гликопротеид, названный проопиомеланокортином. От него отщепляется АКТГ и группа пептидов, включающая β-липотропин, β-эндорфин и α-меланостимулирующий гормон. То же самое происходит и в плаценте.
Биологическая роль β-эндорфина еще мало изучена. Уровень этого вещества во время беременности очень низкий (около 15 пг/мл). Во время потуг количество β-эндорфина возрастает в 5 раз, а при рождении плода —в 7,5—10 раз. Схожие концентрации β-эндорфина (105 нг/мл) отмечены в крови пуповины плода к началу родов.
Источником синтеза β-эндорфиноподобного пептида для обезболивания плода в процессе его прохождения через родовые пути является плацента. Возможно также в этом участвует и гипофиз плода, так как многие факторы, повышающие уровень гипофизарного АКТГ увеличивают и концентрацию β-эндорфина. Гипоксия и ацидоз могут вызвать повышение уровня β-эндорфина, а также β-липотропина и АКТГ.
Как уже было отмечено, плацента синтезирует такие гормоны, как гонадотропин-рилизинг-гормон, тиреотропин-рилизинг-гормон, кортикотропин-рилизинг-гормон, которые аналогичны гипоталамическим гормонам. Вполне вероятно, что плацента синтезирует и другие гормоны — рилизинги, которые вырабатываются цитотрофобластом.
В плаценте выявлен соматостатин, который вырабатывается цитотрофобластом. Отмечено, что по мере прогрессирования беременности синтез гормона уменьшается. При этом снижение продукции соматостатина трофобластом сопровождается усилением секреции ГОТ.
Цитотрофобластом синтезируется релаксин, который является гормоном, относящимся к семейству инсулинов. Релаксин оказывает релаксирующее воздействие на матку, снижает ее сократительную активность, увеличивает растяжимость ткани шейки матки и эластичность лобкового симфиза. Такое действие гормона обусловлено его влиянием на рецепторы, расположенные в амнионе и хорионе. Это в свою очередь способствует активации специфических ферментов, под воздействием которых происходит деградация коллагена и уменьшение синтеза новых коллагеновых элементов.
Эстрогены (эстрадиол, эстрон и эстриол) являются стероидными половыми гормонами, также образуются в фетоплацентарной системе.
В начале беременности, когда плацента еще не сформирована как эндокринный орган и не функционирует корковое вещество надпочечников плода, основное количество эстрогенов вырабатывается в желтом теле яичников матери.
В 12—15 нед беременности продукция эстрогенов возрастает, а среди их фракций начинает преобладать эстриол (Э3). При этом соотношение фракций эстрогенов эстриол — эстрон — эстрадиол составляет 30:2:1. В конце беременности количество эстриола увеличивается в 1000 раз по сравнению с исходным состоянием.
Холестерин, синтезируемый в организме беременной, в плаценте преобразуется в прегненолон и в прогестерон. Плацентарный прегненолон поступает в организм плода и наряду с плодовым прегненолоном в надпочечниках плода трансформируется в дегидроэпиандростерон-сульфат (ДГЭА-сульфат).
В печени плода ДГЭА-сульфат гидролизуется до 16-ОН-ДГЭА-сульфата, который переходит в плаценту, где под воздействием сульфатаз и ароматазы превращается в эстриол.
В печени беременной образуются соединения эстриола с глюкуроновой кислотой — глюкурониды и сульфаты, которые выводятся из организма в основном с мочой и в небольшом количестве с желчью.
Большая часть (90 %) циркулирующего в крови беременных эстриола образуется из андрогенных предшественников плодового происхождения, 10 % эстриола синтезируется в надпочечниках матери.
Плацента и плод представляют собой единую, функционально взаимосвязанную систему синтеза эстрогенов, которые ни плацента, ни плод в отдельности не в состоянии продуцировать в достаточном количестве.
Эстрогены участвуют в регуляции биохимических процессов в миометрии, обеспечивают нормальный рост и развитие матки во время беременности, влияют на ее сократительную активность, увеличивают активность ферментных систем, способствуют повышению энергетического обмена, накоплению гликогена и АТФ, которые необходимы для развития плода. Эстрогены также вызывают пролиферативные изменения в молочных железах и в синергизме с прогестероном участвуют в подготовке их к лактации.
Учитывая, что секреция эстриола преобладает во время беременности над другими фракциями эстрогенов и зависит от предшественников синтезируемых надпочечниками и печенью плода, уровень этого гормона в крови беременных и экскреция его с мочой в большей степени отражают состояние плода, чем плаценты.
При нарушениях со стороны плода уменьшается продукция 16-ОН-ДГЭА, что приводит к уменьшению синтеза эстриола плацентой. Угнетение ферментативной активности плаценты также сопровождается уменьшением выработки Э3.
Эстриол в крови беременных определяют при помощи радиоиммунологического метода с учетом суточных колебаний уровня гормона.
Для определения уровня эстриола в моче используют метод хроматографии.
В первые недели беременности содержание эстрогенов в крови и экскреция их с мочой находится на уровне, соответствующем активной фазе желтого тела у небеременных женщин.
Дальнейшее развитие физиологической беременности сопровождается возрастанием количества эстриола в крови и моче. Учитывая широкие колебания уровня эстриола в течение беременности, рекомендуется проводить повторные динамические исследования гормона, что является более надежным тестом, чем однократная диагностика.
Выраженное снижение, постоянно низкая величина или недостаточный подъем уровня эстриола указывают на нарушения со стороны фетоплацентарной системы.
Для подтверждения ФПН используют также соотношение количества эстриола в плазме крови и в моче, выражающееся эстриоловым индексом, который уменьшается по мере прогрессирования осложнения.
Патологические состояния, связанные с нарушением маточно-плацентарного и фетоплацентарного кровотока, затрудняют обмен предшественников синтеза эстрогенов между плацентой и плодом, нарушают ферментативную активность плаценты, отрицательным образом влияют на процессы жизнедеятельности плода.
Наиболее часто низкие значения эстриола в крови беременных имеют место при наличии задержки развития плода, гипоплазии его надпочечников, анэнцефалии, синдроме Дауна, внутриутробной инфекции и смерти плода.
Снижение экскреции эстриола с мочой до 12 мг/сут и менее свидетельствует о выраженном нарушении фетоплацентарного комплекса.
Терапия кортикостероидами во время беременности вызывает подавление функции коркового вещества надпочечников плода, что приводит к снижению уровня синтеза гормона.
Аналогичный результат может быть получен на фоне приема беременной ампициллина из-за нарушения метаболизма в кишечнике и сокращения объема эстриол-3-глюкуронида, возвращающегося в печень.
Тяжелые заболевания печени у беременной могут приводить к нарушению конъюгации эстрогенов и повышенному выведению их с желчью.
При нарушении функции почек у беременной и снижении клиренса эстриола также происходит уменьшение содержания гормона в моче и повышение его в крови, что не может адекватно отражать состояние плода.
В ряде случаев могут иметь место дефекты ферментных систем плаценты (недостаточность сульфатазы), которые являются причиной низкого значения эстриола при нормальном состоянии плода.
Наличие крупного плода, а также многоплодной беременности нередко влечет за собой повышение уровня эстриола.
Прогестерон является одним из наиболее важных гормонов, влияющих на развитие беременности, и обладает многообразием функций. Под действием этого гормона происходит децидуальная трансформация эндометрия, обеспечивающая имплантацию плодного яйца. Прогестерон подавляет сократительную активность матки и способствует поддержанию тонуса ее истмико-цервикального отдела, создавая опору для растущего плодного яйца. Обладая иммуносупрессивным действием, прогестерон влияет на подавление реакций отторжения плодного яйца, является предшественником синтеза стероидных гормонов плода, а также влияет на обмен натрия в организме беременной, способствуя увеличению объема внутрисосудистой жидкости и адекватному удалению продуктов метаболизма плода.
Нарушение перечисленных функций вследствие снижения уровня прогестерона, особенно в ранние сроки беременности, значительно увеличивает риск ее прерывания и создает предпосылки для развития ФПН.
Кроме того, прогестерон усиливает пролиферативные процессы в молочных железах, подготавливая их к лактации.
На начальных этапах развития беременности (первые 6 нед) основным источником прогестерона является желтое тело, функция которого стимулируется ХГ в синергизме с ПЛ. Постепенно, к 7—8-й неделе беременности, основную функцию в синтезе прогестерона начинает выполнять плацента.
С начала II триместра беременности плацента синтезирует достаточное количество прогестерона, которое может обеспечить нормальное развитие беременности даже при отсутствии яичников. При этом гормон способен накапливаться в различных тканях, создавая своеобразные депо для поддержания его концентрации на должном уровне. В течение всей беременности концентрация прогестерона в крови постоянно возрастает в соответствии с увеличением функционирующей ткани плаценты, достигая своего пика в 38—39 нед.
Из холестерина, содержащегося в материнском организме, в синцитиотрофобласте вырабатывается прегненолон, который преобразуется в прогестерон. От 20 до 25 % выработанного гормона попадает в организм плода, а остальное подвергается метаболизму в печени беременной и выводится с мочой в виде прегнандиола.
Содержание прогестерона в большей степени отражает состояние плаценты и уменьшается при ее морфофункциональных нарушениях, а также при поражении надпочечников и печени плода. Следствием хронической гипоксии плода является снижение концентрации прогестерона как в крови беременных, так и в околоплодных водах (в моче уменьшается экскреция прегнандиола — метаболита прогестерона).
Концентрация уровня прогестерона при беременности зависит от характера осложнения и степени его тяжести. Так, отмечается существенное снижение гормона при угрозе прерывания беременности и гестозе. В соответствии с тяжестью ФПН концентрация прогестерона уменьшается на 30—80 %.
В то же время у беременных с резус-сенсибилизацией и тяжелой формой диабета нередко происходит патологическое увеличение массы плаценты, что приводит к повышению продукции прогестерона и является неблагоприятным диагностическим признаком.
Высокий уровень прогестерона в крови может быть также обусловлен почечной недостаточностью, когда нарушен процесс выведения гормона из организма.
Таким образом, эндокринная функция фетоплацентарного комплекса способствует развитию специфических изменений в репродуктивных органах, регуляции антенатального развития плода и обмена веществ во время беременности.
На начальных этапах развития беременности действие продуцируемых гормонов направлено главным образом на торможение сократительной активности матки и сохранение беременности. При последующем прогрессировании беременности и формировании плаценты ее эндокринная функция обеспечивает адекватные условия для нормального развития плода.
С самого начала беременности происходит торможение циклической гонадотропной функции гипофиза. Концентрация гипофизарного соматотропного и тиреотропного гормонов сохраняется практически такой же, как и до наступления беременности.
Увеличивается количество суммарных (свободных и связанных) тиреоидных гормонов (Т3 и Т4) и кортикостероидов (кортизол). Это обстоятельство обусловлено тем, что под действием эстрогенов в печени усиливается синтез глобулинов, связывающих тиреоидные гормоны и кортикостероиды, что приводит к уменьшению их утилизации. Кроме того, во время беременности повышается чувствительность к существующему уровню адренокортикотропного гормона.
Следовательно, во время беременности тропные функции гипофиза матери резко заторможены. Гормоны периферических эндокринных желез находятся преимущественно в связанном состоянии.
Таким образом, эндокринная функция организма беременной обеспечивается в первую очередь плацентой.
Кроме уже упомянутой роли плода в синтезе эстрогенов, следует остановиться и на других особенностях его эндокринной функции.
Активность эндокринных желез плода, которая начинает проявляться с 11 нед беременности, осуществляется относительно независимо от соответствующих органов материнского организма и направлена в основном на поддержание собственного гомеостаза. С этого срока беременности в организме плода определяются такие гипофизарные гормоны, как фолликулостимулирующий гормон, пролактин, тиреотропный гормон. Содержание адренокортикотропного гормона, который также определяется в организме плода с 10—11 нед, возрастает с 18-й по 26-ю неделю, а затем снижается к 38—40-й неделе.
В ткани яичек плода мужского пола гландулоцитами яичка (клетки Лейдига) синтезируется тестостерон, влияющий на формирование мужского фенотипа плода.
Под воздействием эстрогенов, вырабатываемых в фетоплацентарном комплексе, происходит формирование женского фенотипа плода при наличии соответствующего генотипа.
Функция коркового вещества надпочечников плода проявляется также на 11-й неделе беременности, что по срокам совпадает с активностью его аденогипофиза.
Поступающий к плоду прогестерон служит исходным продуктом для образования в его надпочечниках кортикостероидных гормонов.
Таким образом, гормональная регуляция гестационного процесса осуществляется благодаря эндокринной функции фетоплацентарного комплекса, отдельные звенья которого обладают относительной функциональной самостоятельностью и тесно взаимосвязаны между собой. Ведущая роль в обеспечении гестационного процесса принадлежит эндокринной функции плаценты при непосредственно активном участии плода.
В настоящее время выявлено около 40 различных белков, синтезируемых плацентой.
Трофобластический β-гликопротеид (ТБГ) представляет собой специфический белок беременности — гликопротеид, состоящий из α- и β-единиц, синтез которого осуществляется в клетках Лангханса и синцитиотрофобласте. Определяют содержание белка различными способами, среди которых наиболее простым является иммунодиффузный, а наиболее чувствительными радиоиммунологический и иммуноферментный.
Данный гликопротеид не обладает гормональной и ферментативной активностью. Результаты гистохимических исследований указывают на то, что ТБГ участвует в транспорте железа. Как и другие белки беременности, ТБГ обладает иммуносупрессивной активностью, обеспечивая защиту фетоплацентарного комплекса от повреждающего действия гуморальных и клеточных факторов материнской иммунной системы.
ТБГ выявляется в сыворотке крови у женщин на протяжении всей беременности, начиная с ее ранних сроков. Иммунодиффузным методом белок определяют в 25 % наблюдений с 3—4-й недели беременности, в 75 % — с 4—5-й недели и у 100 % беременных с 5-й недели. Радиоиммунологический метод позволяет обнаружить ТБГ уже с 13-го дня после овуляции.
Иммуноферментный анализ дает положительный результат с 7-го дня после зачатия. С помощью данного метода в моче ТБГ определяется через 9—17 дней после идентификации его в крови. В дальнейшем экскреция белка с мочой постепенно увеличивается пропорционально сроку беременности, достигая 30 мкг/мл в III триместре.
В сыворотке крови концентрация ТБГ при нормальном течении беременности постоянно возрастает, достигая максимальных значений в 34—36 нед либо в 37—38 нед, после чего снижается к моменту родов.
Изменение уровня белка по сравнению с показателями, типичными для физиологического течения беременности, сопровождается развитием осложнений для матери и плода.
Показателе ТБГ при клинической картине угрожающего аборта позволяют прогнозировать возможность пролонгирования беременности или ее прерывания. Нормальный уровень ТБГ при наличии кровяных выделений из половых путей указывает на возможность сохранения и дальнейшего прогрессировать беременности, тогда как снижение концентрации белка чаще всего свидетельствует о неблагоприятном исходе беременности.
Особенно неблагоприятным является снижение концентрации ТБГ в I триместре в 5—10 раз по сравнению с нормой и отсутствие ее нарастания во II и III триместрах.
Повторное исследование уровня ТБГ повышает прогностическую значимость данного теста, позволяя оценить характер развития беременности и эффективность проводимой терапии. Прогрессирующее снижение концентрации белка, стабилизация показателей и/или чрезмерно медленное увеличение содержания ТБГ указывает на отсутствие эффекта проводимого лечения и неизбежность прерывания беременности.
Картина адекватного нарастания концентрации белка в сыворотке крови является критерием успешного лечения и позволяет прогнозировать благоприятный исход беременности.
В III триместре беременности преждевременным родам также предшествует снижение ТБГ, однако прогнозировать время наступления родов по результатам исследования не представляется возможным.
В связи с тем что ТБГ является специфическим белком беременности, который продуцируется плодовой частью плаценты, определение его уровня представляет собой один из элементов оценки функционального состояния фетоплацентарной системы. Более чем в половине наблюдений при наличии задержки развития плода обнаруживается снижение концентрации белка. Выявлена прямая взаимосвязь между степенью выраженности задержки развития плода и уменьшением уровня гликопротеида. Предполагается, что нарушение синтеза ТБГ связано с морфологическими изменениями в плаценте.
Отмечена также взаимосвязь нарушения уровня данного гликопротеида с развитием гипоксии плода. Неблагоприятным признаком рождения детей в асфиксии является снижение более чем в 4 раза уровня ТБГ в 29—36 нед и в такой же степени увеличение концентрации белка в 37—40 нед.
Установлено снижение уровня ТБГ пропорционально тяжести гестоза. Отмечено, что концентрации ТБГ при легком и среднетяжелом гестозе достоверно ниже, чем при физиологически протекающей беременности. Резкое снижение уровня ТБГ в сроки до 24 нед является неблагоприятным прогностическим признаком гестоза.
При многоплодной беременности, сахарном диабете, гемолитической болезни плода, перенашивании беременности уровень ТБГ в сыворотке крови беременных повышается, что связано с большими размерами плаценты.
Плацентарный α1-микроглобулин (ПАМГ) относится к классу низкомолекулярных белков, связывающих инсулиноподобные факторы роста, тем самым модулируя действие гормонов роста. Во время беременности ПАМГ преимущественно синтезируется в основном децидуальной тканью и является индикатором функции материнской части плаценты.
В околоплодных водах в I триместре беременности концентрация этого белка в 100—1000 раз выше, чем в сыворотке крови беременных. Максимальных значений концентрация ПАМГ в амниотической жидкости достигает в 20—24 нед беременности и к 35 нед снижается в 15 раз.
Прогрессирующее нарастание концентрации ПАМГ (превышающее нормативные значения) пропорционально тяжести и длительности гестоза. Повышение содержания белка при гестозе, вероятно, связано с нарушением плацентарного барьера и попаданием его из амниотической жидкости в кровь беременных.
Нарастание концентрации ПАМГ в сыворотке крови беременных при гестозе подтверждено также в работах с использованием радиоиммунного анализа. Отмечено, что наличие ПАМГ в сыворотке крови у беременных с гестозом предшествует рождению детей в состоянии асфиксии или с гипотрофией. Частота рождения здоровых детей у женщин с гестозом при отрицательном результате выявления ПАМГ составляет 93 %.
У женщин с привычным невынашиванием беременности при наличии фетоплацентарной недостаточности и задержки развития плода выявлено повышение содержания ПАМГ в сыворотке крови, в 2—10 раз большее, чем при физиологическом течении беременности.
α2-микроглобулин фертильности (АМГФ). Также определяется в плаценте. Его содержание в плацентарной ткани составляет 6,9 % от всех белков плаценты. Концентрация АМГФ в плаценте в I и II триместрах беременности в 100 раз выше, чем в III триместре. Синтез белка осуществляется в децидуальной ткани, отражая функцию материнской части плаценты.
В первой половине беременности АМГФ выделяется в основном в амниотическую жидкость, и его концентрация почти в 200 раз превышает уровень, определяемый в сыворотке крови.
Уровень протеина в околоплодных водах достигает максимальной величины в 10—20 нед, после чего его концентрация снижается.
Содержание АМГФ в сыворотке крови у женщин при наступлении беременности нарастает достаточно быстро с самых ранних ее сроков, достигая максимальных значений между 6 и 12 нед. Далее концентрация протеина начинает снижаться (до 24 нед) и впоследствии остается неизменной до срока родов.
Предполагается, что АМГФ является рецептором кортикостероидных гормонов или их переносчиком. Обнаружена также его иммуносупрессивная активность.
При невынашивании беременности происходит снижение уровня протеина в ранние сроки и его повышение в поздние сроки. Прогностически неблагоприятным является концентрация белка ниже 100 нг/мл в I триместре и выше 100 нг/мл в III триместре.
Исследования, проведенные среди беременных с гестационной гипертензией, показали увеличение содержания АМГФ в сыворотке крови в 80 % наблюдений. Наличие или отсутствие при этом протеинурии не влияло на результаты выявления белка.
При наличии задержки развития плода отмечена только тенденция к снижению показателей АМГФ.
Неблагоприятным прогностическим признаком при гипоксии плода является повышение уровня АМГФ в 34—38 нед и в 39—41 нед, что свидетельствует о нарушении биологического барьера между кровью матери и плода.
α-Фетопротеин (АФП). Представляет собой специфический фетальный глобулин, который первоначально с 6 нед синтезируется в желточном мешке эмбриона, а начиная с 13 нед беременности — в печени плода. В ранние сроки беременности АФП составляет около 30 % белков плазмы плода. Концентрация АФП взаимосвязана со сроком беременности и массой плода, что позволяет судить о степени его развития в соответствии с гестационным сроком. В амниотическую жидкость и кровь беременных АФП попадает из организма плода. Максимальное содержание АФП в околоплодных водах (23 мг/л) отмечается в 14—15 нед с последующим постепенным снижением до 1 мг/л.
В I триместре беременности концентрация АФП в крови матери меньше, чем в околоплодных водах. В ходе дальнейшего формирования барьерных структур плода проникновение АФП в околоплодные воды уменьшается, а его трансплацентарное поступление в кровь беременной нарастает. В крови беременных увеличение концентрации АФП происходит с 10 нед (10—20 нг/мл), достигая максимальных величин в 32—34 нед (до 300 нг/мл). В дальнейшем концентрация белка в сыворотке крови беременных снижается до 80— 90 нг/мл.
Степень проникновения АФП из организма плода в околоплодные воды и кровь беременной в основном зависит от функции почек и желудочно-кишечного тракта плода, а также от проницаемости плацентарного барьера.
Увеличение или понижение содержания АФП по сравнению с уровнем, характерным для нормального течения беременности, является признаком нарушения состояния плода.
К повышению уровня АФП в сыворотке крови и околоплодных водах приводит ряд аномалий развития плода (врожденное отсутствие почек, атрезия двенадцатиперстной кишки, гастрошизис, омфалоцеле, менингомиелоцеле, гидроцефалия, анэнцефалия и др.), а также некоторые осложнения беременности (изосерологическая несовместимость матери и плода, смерть плода).
При аномалии развития почек плода возрастает прямой переход АФП в околоплодные воды. В результате атрезии желудочно-кишечного тракта нарушается обратное заглатывание АФП плодом околоплодных вод, что приводит к повышению его уровня в сыворотке крови беременной. Открытый дефект нервной трубки плода способствует повышению концентрации АФП путем прямого попадания белка в околоплодные воды. При анэнцефалии нарушаются глотательные движения плода, что также приводит к высокому уровню АФП в сыворотке крови беременных. Смерть плода характеризуется резким повышением уровня АФП вследствие увеличения проницаемости плацентарного барьера и высвобождения большого количества белка.
Задержка развития плода, которая сопровождается нарушением продукции АФП печенью, приводит к снижению его концентрации в околоплодных водах и в сыворотке крови беременных.
Снижение концентрации АФП (в 2 раза меньше средних нормативных значений для данного срока беременности) может быть обусловлено и синдромом Дауна.
Морфофункциональная незрелость плода сопровождается нарушением белкового обмена и замедленным снижением содержания АФП в конце беременности. При этом содержание АФП в 39—40 нед на том же уровне, как и в 32— 34 нед, что является неблагоприятным прогностическим признаком.
РАРР-А (pregnancy-associated plasma protein-А) — ассоциированный с беременностью протеин-А плазмы крови, является высокомолекулярным тетрамером, относящимся к ферментам класса металлопептидаз. РАРР-А не является сугубо специфичным для беременности. Его концентрации обнаруживаются и у небеременных женщин. При этом белок синтезируется клетками эндометрия, а также в толстой кишке и почках, обнаруживается в фолликулах и слизистой оболочке маточных труб.
Во время беременности РАРР-А образуется в клетках синцитиотрофобласта. Концентрация белка начинает значительно увеличиваться с 7— 8 нед беременности, удваиваясь через каждые 4— 5 дней, и к 10-й неделе возрастает примерно в 100 раз. Дальнейший рост уровня РАРР-А продолжается в течение всей беременности, достигая к ее окончанию 100 мкг/мл.
Нормальный уровень РАРР-А в I триместре в 99 % ассоциирован с благоприятными исходами беременности.
Определение уровня РАРР-А в сыворотке крови используют для пренатальной диагностики синдрома Дауна и других врожденных пороков развития плода. При данной патологии уровень РАРР-А значительно снижен. Обычно с этой целью наряду с определением уровня РАРР-А оценивают также концентрацию АФП и свободной β-субъединицы ХГ.
Низкий уровень РАРР-А в I триместре беременности более чем в половине наблюдений предшествует самопроизвольному ее прерыванию. Низкое содержание белка характерно также и для эктопической беременности, что обусловлено замедленным созреванием трофобласта из-за отсутствия контакта с эндометрием и недостаточного кровоснабжения.
РАРР-А относится к группе белков-иммуносупрессоров наряду с ХГ, ТБГ и АФП, обеспечивая подавление иммунной реактивности материнского организма к развивающемуся плоду. В связи с тем что этот белок играет важную роль в обеспечении иммунной толерантности плода, его дефицит следует расценивать как одно из проявлений ФПН.
Околоплодные воды являются неотъемлемой составной частью фетоплацентарного комплекса. Они защищают плод от неблагоприятных внешних воздействий, создают условия для его развития, полноценной двигательной активности, препятствуют нарушению кровотока по сосудам пуповины.
Увеличение объема околоплодных вод в зависимости от срока беременности происходит неравномерно. Максимальное их количество отмечается в 37—38 нед, а затем, ближе к сроку родов, несколько уменьшается до 800—900 мл.
Амниотическая жидкость в основном продуцируется амниотическим эпителием, а в более поздние сроки в этом процессе активное участие принимает и плод. К концу беременности плод продуцирует около 600—800 мл мочи, которая является значительной составной частью амниотической жидкости. Кроме того, через легкие плода происходит диффузия около 600—800 мл жидкости в сутки.
Обмен околоплодных вод осуществляется через амнион и хорион. Полный обмен околоплодных вод происходит в среднем за 3 ч.
Околоплодные воды представляют собой в основном фильтрат плазмы крови, содержащий белки, липиды, углеводы, гормоны, ферменты, витамины, факторы, влияющие на свертывание крови (тромбопластин, фибринолизин, факторы X и XIII), другие биологически активные вещества, а также кислород и углекислый газ.
Изменения половой системы
Гормональный статус. Во время беременности организм матери оптимально насыщен гормонами. Влияние гормональной активности плаценты особенно ярко отражается на изменениях со стороны матки. Длина мышечных волокон матки во время беременности увеличивается в 15 раз, а масса матки возрастает с 50 до 1000 г к сроку родов. В первые недели беременности этот рост осуществляется за счет гиперплазии и гипертрофии мышечных волокон, происходящей таким образом, что матка принимает округлую, а далее овоидную форму с толстыми стенками.
Начиная с 20-й недели рост матки почти прекращается, а увеличение ее размеров происходит за счет растяжения мышечных волокон под механическим воздействием со стороны растущего плода. При растяжении матки ее стенки становятся тоньше. К концу беременности объем полости матки увеличивается более чем в 500 раз.
Наряду с гипертрофией возрастает количество гладкомышечных клеток (процессы пролиферации). Новые мышечные клетки образуются из перицитов — клеток мышечного слоя маточных сосудов. Этот процесс контролируется высоким содержанием эстрогенов и прогестерона, а также ростовыми факторами.
Одновременно происходит увеличение соединительнотканного каркаса матки (за счет усиления продукции экстрацеллюлярного матрикса), который вместе с пучками миометрия создает прочную и упругую стенку матки.
Соединительнотканный каркас обеспечивает быстрое распространение импульсов от одной клетки к другой, обеспечивая деполяризацию мембран и последующее сокращение миоцитов. По мере развития соединительнотканного каркаса сокращения матки учащаются. Вначале они проявляются в виде отдельных сокращений типа схваток Брэкстон — Гикса. Это нерегулярные и безболезненные сокращения в последующем с нарастающей частотой проявляются во второй половине беременности.
Периодическое повышение тонуса матки и нерегулярные сокращения ее отдельных участков обеспечивают отток венозной крови, что в свою очередь оптимизирует приток артериальной крови.
Растяжение матки во время беременности происходит в основном за счет передней стенки, тогда как задняя стенка растягивается мало. Поэтому, если плацента расположена низко по передней стенке матки, она чаще всего подвергается «миграции» (поднимается вверх). При локализации плаценты по задней стенке она практически не подвергается «миграции». Максимальное растяжение матки при физиологическом течении беременности происходит в 30—35 нед, после чего она больше не растягивается.
По мере развития беременности происходят значительные изменения сосудистой системы матки. Сосуды матки удлиняются, штопорообразно извиваются, внутренняя оболочка артерий в области субплацентарной зоны замещается слоем фибриноида.
Мышечные клетки в спиральных артериях почти полностью подвергаются процессам апоптоза. Все эти изменения направлены на улучшение кровотока в субплацентарной зоне и интравиллезных пространствах. По кровоснабжению и кислородному режиму матка при беременности приближается к таким жизненно важным органам, как сердце, печень и мозг.
Маточно-плацентарный и плодово-плацентарный кровоток мало зависят от изменений в общей системе гемодинамики и характеризуются определенным постоянством, что обеспечивает плоду необходимый гомеостаз.
Миометрий состоит из тонкого наружного слоя (с преобладающим продольным расположением мышечных волокон); толстого среднего слоя со сложным переплетением гладкомышечных пучков, содержащего большое количество сосудов разного калибра, и внутреннего слоя из циркулярно расположенных мышечных волокон.
Внутренний слой матки, который также называют «зоной молчания», не сокращается, так как имеет своеобразное расположение. Он довольно тонкий в дне матки, утолщается в области тела и имеет максимальную толщину в шейке, где он сочетается с эластическими и коллагеновыми волокнами.
Ко времени полного созревания плода и к началу интенсивных инволюционных процессов «стареющей» плаценты (38 нед беременности) этот внутренний слой, близко соприкасающийся с тканями плода, плаценты и децидуальной оболочкой, как бы отражает синхронную готовность плода и матери к развитию родовой деятельности.
Отсутствие признаков «зрелости» шейки или недостаточная степень ее «созревания» свидетельствует о нарушении синхронной готовности организма матери или плода к родам.
Чаще всего «незрелая» шейка матки является результатом низкой экспрессии плодовых простагландинов (ПГЕ, и ПГЕ2) или простагландинов ПГЕ2α (материнского генеза).
К концу беременности увеличивается продукция сократительных белков в миометрий, содержание АТФ, накопление фосфорных соединений. Усиливается интенсивность окислительно-восстановительных процессов. На поверхности гладкомышечных клеток, объединенных в пучки, слои, которые ориентированы в продольном, поперечном, косом направлениях, повышается количество α- и β-адренорецепторов. В зависимости от воздействия на них сокращающих или расслабляющих факторов различные отделы матки либо сокращаются (локальный тонус матки), либо расслабляются.
Во время беременности единого синхронного взаимодействия между пучками гладкомышечных клеток нет. Вся матка как бы разделена на зоны, которые независимо друг от друга то сокращаются, то расслабляются в разном темпе и несинхронно по времени. Этим обеспечивается дополнительный механизм освобождения матки от венозной крови и улучшения артериального кровоснабжения.
Только к 38 нед беременности наблюдается постепенная синхронизация сокращений тела матки и одновременное расслабление нижнего сегмента и шейки матки (т. е. расслабления внутреннего слоя матки).
Эти подготовительные схватки обеспечивают процессы укорочения и постепенного открытия внутреннего зева и шеечного канала («созревание» шейки матки), которые определяются как синдром «зрелой шейки матки» к сроку 38— 40 нед беременности.
В процессе развития беременности из перешейка формируется нижний сегмент матки. Если в I триместре беременности длина перешейка составляет 0,5—1 см, то к концу III триместра она увеличивается до 5 см, а в процессе родов до 10—12 см. К концу беременности шейка располагается по оси таза, укорочена до 1,5—1,0 см, размягчена. Размягчение происходит от периферии к центру. Недостаточное размягчение определяют по симптому «плотный стержень в мягком футляре». Шеечный канал открывается на ширину 0,5—1,0 см (пропускает 1 палец акушера). Имеет место плавный переход шеечного канала в нижний сегмент матки. При недостаточной «зрелости» шейки матки внутренний зев определяется в виде плотного валика.
Сосудистая система матки во время беременности характеризуется повышенной интенсивностью кровообращения. Снабжение матки кровью происходит через анастомозы между артериями матки, яичника и влагалища. На поверхности матки также имеются множественные сосудистые анастомозы.
В результате действия эстрадиола и прогестерона ткань шейки матки размягчается.
Эстрадиол стимулирует рост цилиндрического эпителия шеечного канала, вследствие чего во время беременности нередко формируются псевдоэрозии. Во время беременности цвет шейки матки цианотичный, что обусловлено повышенной васкуляризацией и кровенаполнением. Железы шейки матки расширяются и становятся более разветвленными. Ближе к сроку родов под действием ПГЕ2 и коллагеназы происходит размягчение шейки матки и ее «созревание», что отражает готовность организма беременной к родам.
В результате гормональных изменений происходит гиперплазия и гипертрофия мышечной и соединительной ткани влагалища. Отмечается также повышение васкуляризации стенок влагалища. Слизистая оболочка приобретает характерный цианотичный оттенок. Эпителий влагалища под влиянием эстрогенов во время беременности утолщается, активизируется процесс его слущивания, что приводит к увеличению количества отделяемого из влагалища.
Микрофлора половых путей. Нормальная микрофлора влагалища у здоровых беременных характеризуется большим разнообразием видов бактерий, жизнедеятельность которых во многом зависит от их способности к адгезии на клетки вагинального эпителия и возможности конкуренции между собой за места обитания и продукты питания. Влагалищная микрофлора строго индивидуальна и может даже в состоянии нормы подвергаться изменениям. Кроме того, понятие нормы может быть различным для разных возрастных, этнических групп и даже географических зон. В связи с этим возможны варианты нормального микробиоценоза (нормоценоза) влагалища:
ВИДОВОЙ СОСТАВ НОРМАЛЬНОЙ МИКРОФЛОРЫ ВЛАГАЛИЩА
| Факультативные микроорганизмы | Анаэробные микроорганизмы |
| Грамположительные кокки | Грамположительные кокки |
| Staphylococcus epidermidis Staphylococcus aureus* Group D Streptococcusβ-Hemolytic Streptococcus
Другие виды стрептококков | Peptococcus species*Peptococcus anaerobius Peptococcus asaccharolyticus Peptococcus prevotii*
Peptococcus varibilis Peptostreptococcus species* Peptostreptococcus anaerobius |
| Грамположительные палочки | Грамотрицательные кокки |
| Lactobacillus species* Corinebacterium species | Veillonella species Acidominococcus fermentas |
| Грамотрицательные палочки | Грамположительные палочки |
| Echerichia coli* Klebsiella speciesДругие виды семейства Enterobacteriaceae | Lactobacillus species* Bifidobacterium species Clostridium species Eubacterium species
Propionibacterium species |
| Грамотрицательные палочки | |
| Bacteroides melaninogenicus* Bacteroides vulgais* Bacteroides species* Fusobacterium nucleatum*
Fusobacterium species* (группа Sphaerophorus) Leptotrichia species Campylobacter species («anaerobic vibrios») |
* Микроорганизмы, имеющие наибольшее клиническое значение.
Отделяемое влагалища в норме содержит 106— 1010 КОЕ/мл микроорганизмов и состоит из разнообразных видов, число которых может достигать 40 и более. Факультативно-анаэробные бактерии составляют 103—105 КОЕ/МЛ, а анаэробные — 105—106 КОЕ/мл (табл. 5.1). При этом количество анаэробов относится к количеству аэробов как 10:1. На фоне всего видового многообразия ведущее место в вагинальном микроценозе занимают микроаэрофильные лактобактерии, число которых может достигать 109 КОЕ/мл.
Колонизируя слизистую оболочку влагалища, лактобактерии участвуют в формировании экологического барьера и обеспечивают тем самым резистентность вагинального биотопа. Защитные свойства лактобактерий реализуются по-разному: за счет антагонистической активности, способности продуцировать лизоцим, перекись водорода, а также за счет адгезивных свойств. Однако основным механизмом, обеспечивающим колонизационную резистентность, является способность лактобактерий к кислотообразованию. Молочная кислота образуется в процессе деструкции гликогена вагинального эпителия и определяет кислую реакцию РН вагинального содержимого, которая в норме составляет 3,8—4,5. Лактобактерий продуцируют молочную кислоту в количествах, достаточных для создания выраженной кислой среды вагинального отделяемого и тем самым препятствуют размножению ацидофобных бактерий. Таким образом, определяющим фактором состояния вагинального микроценоза является лактофлора, ее концентрация и совокупность свойств.
Лактобактерий не являются единственной «протективной» составляющей микрофлоры мочеполовых путей. Бифидобактерии, входя в состав микроценоза влагалища, как и бактерии рода Lactobacillus, относятся к флоре Додерлейн и являются кислотопродуцирующими микроорганизмами, участвуя в поддержании низких значений рН во влагалище. Бифидобактерии адгезируются на поверхности эпителиальных клеток влагалища, способны продуцировать бактериоцины, лизоцим, спирты, что также обеспечивает им участие в создании и поддержании колонизационной резистентности по отношению к условно-патогенным и патогенным микроорганизмам. Кроме того, бифидобактерии синтезируют аминокислоты и витамины, которые активно используются организмом хозяина в его метаболизме. Наиболее часто встречаются B.bifidum и B.breve (у 37,5 % женщин), B.adolescentis (у 25 %), B.longum (12,5 %). Имеются сведения о том, что клеточная стенка бифидобактерии обладает иммуностимулирующей активностью и обеспечивает формирование более выраженного иммунного ответа макроорганизма по отношению к чужеродному агенту.
Пептострептококки являются третьей составляющей частью флоры Додерлейн. Количество анаэробных кокков в вагинальном отделяемом составляет 103—104 КОЕ/мл. Несмотря на то что пептострептококки составляют часть нормальной флоры женских половых путей, их часто обнаруживают при септических абортах, трубно-яичниковых абсцессах, эндометритах и других тяжело протекающих инфекциях женских половых органов. В ассоциации с другими анаэробными бактериями пептострептококки в большом количестве случаев выделяются при бактериальном вагинозе.
Таблица 1. Степень обсемененности вагинального отделяемого различными видами микроорганизмов у беременных
| Микроорганизм | Количество, КОЕ/мл |
| Микроаэрофильные бактерии | |
| Lactobacillus spp. | 107-109 |
| G. vaginalis | 106 |
| Облигатно-анаэробные грамположительные бактерии | |
| Lactobacillus spp. | 107-109 |
| Bifidobacterium spp. | 103-107 |
| Clostridium spp. | До 104 |
| Propionibacterium spp. | До 104 |
| Mobiluncus spp. | До 104 |
| Peptostreptococcus spp. | 103-104 |
| Облигатно-анаэробные грамотрицательные бактерии | |
| Bacteroides spp. | 103-104 |
| Prevotella spp. | До 104 |
| Porphyromonas spp. | До 103 |
| Fusobacterium spp. | До 103 |
| Veilonella spp. | До 103 |
| Факультативно-анаэробные грамположительные бактерии | |
| Corynebacterium spp. | 104-105 |
| Staphylococcus spp. | 103-104 |
| Streptococcus spp. | 104-105 |
| Enterobacteriaceae | 103-104 |
| M. hominis | 103 |
| U. urealyticum | 103 |
| M. fermantas | До 103 |
| Дрожжеподобные грибы рода Candida | 104 |
Пропионобактерии — комменсалы человеческого организма. За счет вырабатываемых ими органических кислот эти бактерии могут участвовать в поддержании колонизационной резистентности влагалища. Данные микроорганизмы обладают иммуностимулирующими свойствами и выделяются в количествах, не превышающих в норме 104 КОЕ/мл.
Органические кислоты, продуцируемые грамотрицательными анаэробами, а также бактериями рода Mobiluncus, в частности янтарная кислота, ингибируют функциональную активность полинуклеарных нейтрофилов, с чем связывают малое количество последних или их полное отсутствие в выделениях из влагалища при бактериальном вагинозе. Количество гарднерелл нередко достигает 106 КОЕ/мл исследуемого материала. Гарднереллы обладают выраженной способностью к адгезии на поверхности вагинальных эпителиоцитов. G.vaginalis могут продуцировать токсичные биопродукты, к которым относятся муколитические ферменты и гемолизин, являющийся также лейкотоксическим фактором.
Во влагалище здоровых женщин коринебактерии обнаруживаются в количестве 104—105 КОЕ/мл, генитальные микоплазмы и стафилококки встречаются не более 104 КОЕ/мл. Количество стрептококков в вагинальном отделяемом значительно варьирует и по разным данным составляет 104— 105 КОЕ/мл. Инфицирование новорожденных S. agalactiae может произойти во время родов при прохождении через родовые пути в случае преждевременного разрыва плодных оболочек или при акушерских манипуляциях, сопровождающих сложные роды. Стрептококки этого вида способны вызвать тяжелые заболевания органов дыхания, менингит, септицемию, нередко приводящие к летальному исходу. Зеленящие стрептококки могут быть причиной послеоперационных воспалительных осложнений.
Энтеробактерии — E.coli, Proteus spp. Klebsiella spp., а также P. aerugenosa встречаются в количестве 103—104 КОЕ/мл и могут быть этиологическим агентом урогенитальных инфекционных заболеваний. Грибы рода Candida определяются в количестве до 104 КОЕ/мл, не вызывая патологических процессов. Количество дрожжеподобных грибов может повышаться при беременности. Это связывают с тем, что при физиологической супрессии клеточного иммунитета, происходящей у беременных женщин и направленной на исключение возможности отторжения развивающегося плода, создаются благоприятные условия для роста и размножения дрожжеподобных грибов. Выявлено, что C. albicans обладает способностью прикрепляться к вагинальным эпителиоцитам при помощи специальных поверхностных структур, а также вырабатывать глиотоксин, который способен нарушать жизнеспособность и функцию человеческих лейкоцитов. С другой стороны, было обнаружено, что C.albicans могут вырабатывать так называемый антинейссериа-фактор, который способен подавлять размножение и колонизацию влагалища N.gonorrhoeae.
Таким образом, бактерии — представители нормальной микрофлоры влагалища, тесно взаимодействуя между собой и с клетками вагинального эпителия, создают и поддерживают высокую колонизационную резистентность влагалищного биотопа, но иногда могут стать причиной воспалительных процессов мочеполовых путей. Ввиду того что вагинальная микрофлора, помимо защитной функции, выполняет и ряд других важных функций — ферментативную, витаминообразующую, иммуностимулирующую и др., ее обычно рассматривают как индикатор состояния влагалища.
Видовое разнообразие вагинальной микрофлоры велико, а возможные сочетания микроорганизмов столь многочисленны, что можно говорить лишь о некоторых общих тенденциях. Большинство исследователей считают, что у здоровых женщин, кроме лактобацилл, чаще всего во влагалище обнаруживают непатогенные коринебактерии и коагулазоотрицательные стафилококки—у 60—80 % обследованных. Среди облигатно-анаэробных бактерий преобладают Prevotella, что связано с их высокой значимостью как этиологических агентов при воспалительных заболеваний гениталий. Эти бактерии встречаются в низких титрах у 5 % здоровых женщин.
Таблица 2. Физиологическое состояние влагалищной экосистемы у беременных
| Показатели | Беременность |
| Уровень эстрогенов | Высокий |
| Значение рН | Кислый |
| Окислительно-восстановительный потенциал | Повышен |
| Содержание гликогена | Очень высокое |
| Облигатные анаэробы | Не преобладают |
| Общее количество бактерий | Повышено |
| Разнообразие микроорганизмов | Понижено |
Во время беременности морфофункциональные, физиологические и биохимические изменения в половых путях приводят к тому, что вагинальная микрофлора становится более однородной. Под влиянием гормонов желтого тела и плаценты слизистая оболочка влагалища становится особенно толстой. Эластичность клеток промежуточного слоя увеличивается, синтез гликогена в них осуществляется с максимальной интенсивностью, создаются благоприятные условия для жизнедеятельности лактобактерий. По мере развития беременности снижается численность транзиторных микроорганизмов и увеличивается количество лактобактерий. В связи с постоянно низкими показателями рН создаются благоприятные условия для количественного увеличения некоторых микроорганизмов транзиторной группы, таких как генитальные микоплазмы и дрожжеподобные грибы. По мере развития беременности и особенно к сроку родов снижается количество аэробных видов, таких как колиформные бактерии, и таких облигатных анаэробов, как бактероиды и пептострептококки. Эти изменения достигают пика в III триместре беременности, что в последующем снижает вероятность контаминации плода условно-патогенными микроорганизмами при его прохождении через родовые пути. Таким образом, к родам снижается уровень микробного обсеменения родовых путей при максимальном доминировании лактобактерий, и ребенок рождается в условиях преобладания ацидофильных бактерий, обеспечивающих колонизационную резистентность родового канала (табл. 2).
Молочные железы
В процессе беременности в молочных железах происходят изменения, направленные на подготовку к последующей лактации. Возрастает кровоснабжение молочных желез. В результате гормональных изменений под действием эстрогенов, прогестерона, плацентарного лактогена происходят пролиферативные процессы в тканях протоков и альвеол. Их количество увеличивается. При этом происходит увеличение объема долек молочных желез. Со второй половины беременности в ткани молочной железы образуются жировые включения. В альвеолах повышается синтез казеина, лактоглобулина и лактальбумина. К концу беременности при надавливании на соски из них выделяется молозиво, богатое иммуноглобулинами.
Нервная система
Функция ЦНС претерпевает определенные изменения во время беременности, что проявляется формированием в коре полушарий большого мозга гестационной доминанты, представляющей собой очаг повышенной возбудимости. Возбудимость нижележащих отделов ЦНС и нервного аппарата матки снижена, что обеспечивает ее релаксацию. Незадолго до родов их возбудимость возрастает, что создает благоприятные условия для начала родов.
Матка, как и все внутренние органы, иннервируется вегетативной нервной системой, которая регулирует сокращения, кровоснабжение матки, за исключением плаценты (последа).
Вегетативная система действует автономно, контролируя кровеносные сосуды, сердце, гладкую мускулатуру кишечника, бронхов, мочевого пузыря, матки и других органов. Регулируя активность иннервируемых ею клеток в различных органах, вегетативная нервная система обеспечивает структурно-функциональные изменения в организме беременной.
Во время беременности преобладает активность симпатико-адреналового отдела вегетативной нервной системы. При этом происходит стимуляция деятельности сердечно-сосудистой и дыхательной систем, усиливается кровоснабжение почек.
Сердечно-сосудистая система
Физиологические адаптационные изменения в организме беременной оказывают существенное влияние на ее сердечно-сосудистую систему, которая функционирует с повышенной нагрузкой. Это обусловлено:
- появлением нового круга кровообращения в системе мать — плацента — плод;
- увеличением ОЦК;
- возрастанием общей массы тела;
- повышением внутрибрюшного давления.
Происходящие во время беременности изменения в деятельности сердечно-сосудистой системы направлены на обеспечение жизнедеятельности организма беременной, а также доставки к плоду в должном объеме кислорода и питательных веществ и удаления продуктов его метаболизма.
В ответ на повышенную нагрузку увеличивается масса миокарда, размеры отделов сердца. С увеличением ОЦК сердечный выброс повышается в среднем на 30—40 % от величины выброса до беременности. Увеличение этого показателя отмечается уже с 8 нед беременности. Минутный объем сердца возрастает с началом раннего фетального периода, достигая максимума к концу II триместра (28—32 нед), составляя 6—7 л/мин. В этот же период существенно возрастает венозный возврат крови к сердцу и усиливаются сокращения правого желудочка.
Увеличение ОЦК отмечается с I триместра беременности, достигая максимальных значений в 29—36 нед. Изменения показателей центральной гемодинамики, происходящие во время беременности, представлены в табл. 3.
Таблица 5.3. Изменения показателей центральной гемодинамики во время беременности
| Показатели | Вне беременности | В конце беременности |
| Объем крови, мл | 3500 | 5000 |
| Среднее артериальное давление, мм рт. ст. | 86 ± 8 | 90 ±6 |
| Сердечный выброс, л/мин | 4,3 ± 1 | 6,2 ± 1 |
| ЦВД, мм водн. ст. | 4±3 | 4± 3 |
| Давление заклинивания в легочных капиллярах, мм рт. ст. | 6±2 | 8 + 2 |
| Легочное сосудистое сопротивление, дин/(с • см5) | 119 ± 47 | 78 ±22 |
Изменения показателей сердечно-сосудистой адаптации, происходящие во время беременности, представлены в табл. 4.
Таблица 5.4. Изменения показателей сердечно-сосудистой адаптации во время беременности
| Показатели | I триместр | II триместр | III триместр |
| Ударный объем сердца, мл | 70 | 90 | 60 |
| ЧСС, уд/мин | 60-80 | 80-90 | 80 |
| Увеличение МОС, % | 15 | 45 | 0-5 |
| Периферическое сосудистое сопротивление, дин/(с • см5) | 1300-1500 | 980 | 1200 |
| Вязкость крови, усл. ед. | 4,2 | 3,75 | 3,99 |
При беременности изменяются как размеры, так и положение сердца. Сердце несколько расширяется за счет дилатации и гипертрофии миокарда. Дилатация в области правого предсердно-желудочкового (трикуспидального) клапана может вызывать незначительную регургитацию с появлением систолического шума. Смещение диафрагмы увеличенной маткой сдвигает сердце влево и кпереди таким образом, что верхушечный толчок перемещается кнаружи и вверх.
Несмотря на повышенную нагрузку на сердце во время беременности, у здоровых женщин не происходит нарушения ритма сердца. У беременной с заболеваниями сердца и его низкими функциональными резервами повышенная активность может спровоцировать сердечную недостаточность.
Системное артериальное давление во время нормальной беременности не повышается. С 9 нед беременности артериальное давление снижается на 8—42 мм рт. ст., сохраняясь на этом уровне до середины беременности. Давление в легочном стволе практически остается на неизменном уровне.
Снижение периферического сосудистого сопротивления обусловлено образованием маточного круга кровообращения с низким сопротивлением, а также сосудорасширяющим действием эстрогенов и прогестерона.
Центральное венозное давление не меняется. Особенно высокое венозное давление отмечается в бедренной вене у лежащей на спине пациентки (сдавление маткой нижней полой вены). Поэтому нередко во время беременности возникает варикозное расширение вен малого таза, наружных половых органов и нижних конечностей.
Растяжение вен во время беременности может достигать 150 % от исходного уровня. Венозные концы капилляров расширяются, снижая тем самым интенсивность тока крови.
Начиная с середины беременности, в положении лежа на спине увеличенная в размерах матка может сдавливать нижнюю полую вену и аорту. Сужение просвета нижней полой вены уменьшает венозный возврат крови к сердцу, что приводит к снижению сердечного выброса до 24 % от исходного. Большинство женщин могут компенсировать падение ударного объема за счет увеличения. При этом артериальное давление быстро снижается. Кожные покровы становятся бледными с цианотичным оттенком. Отмечается нитевидный пульс. Первой помощью в этой ситуации является изменение положения тела пациентки, которую следует повернуть на правый или левый бок. После этого состояние быстро улучшается, артериальное давление и пульс нормализуются. Если этого не сделать, может наступить смерть плода, а также выраженное ухудшение состояния беременной.
Во время беременности активизируется ренин-ангиотензиновая система. В циркулирующей крови возрастает содержание ангиотензина II, который способствует задержке натрия и воды в организме, увеличивает ОЦК и оказывает вазоконстрикторное действие. Поэтому даже здоровым беременным женщинам следует ограничивать потребление соли и сохранять умеренный водный режим.
Система дыхания
Система дыхания во время беременности находится в состоянии функционального напряжения, так как потребление кислорода к концу беременности возрастает на 30—40 %, а во время схваток в родах до 150—200 %.
Во время беременности в системе дыхания происходят следующие изменения:
- учащение дыхания на 10 %;
- увеличение дыхательного объема к концу беременности на 30—40 %;
- возрастание минутного объема дыхания с 12 нед до 11 л/мин;
- увеличение альвеолярной вентиляции легких;
- увеличение жизненной емкости легких на 100-200 мл (5 %);
- снижение общей емкости легких вследствие высокого стояния диафрагмы;
- увеличение работы дыхательных мышц из-за повышенной потребности в кислороде;
- снижение содержания кислорода в артериальной крови;
- снижение парциального давления углекислого газа на 15—20 % в связи с гипервентиляцией.
Изменения со стороны сосудов дыхательных путей (вследствие гормональной перестройки в организме беременной) приводят к капиллярному застою и набуханию слизистой оболочки носа, ротоглотки и трахеи. Во время беременности могут отмечаться симптомы ринита, изменение голоса. Эти симптомы могут усугубляться при перегрузке организма жидкостью, возникновении отеков, гипертензии или гестозе.
Матка при беременности смещает диафрагму вверх на 4 см, однако общая емкость легких изменяется незначительно из-за компенсаторного увеличения переднезаднего и транслатерального размеров грудной клетки, а также увеличения межреберных промежутков. Эти анатомические изменения обусловлены действием гормонов на свойства связочного аппарата. Несмотря на смещение вверх, диафрагма во время дыхания у беременных двигается с большими экскурсиями, чем у небеременных. Дыхание при беременности больше диафрагмальное, нежели грудное, что имеет определенные преимущества при положении пациентки на спине. Одышка, которая часто отмечается при беременности, обусловлена увеличением дыхательного объема, а не частотой дыхания.
Прогрессивное увеличение минутной вентиляции начинается с самых ранних сроков беременности и ко II триместру достигает своего максимального прироста на 50 %. Это происходит за счет увеличения дыхательного объема на 40 % и увеличения частоты дыхания на 15 %. Из-за того что мертвое пространство остается неизменным, альвеолярная вентиляция к концу беременности становится примерно на 70 % выше.
Вследствие увеличения дыхательного объема значительно (на 15—20 %) снижается величина парциального давления углекислого газа, и несколько повышается парциальное давление кислорода, что существенно облегчает газообмен между организмом матери и плода.
Иммунная система
Изменения в иммунной системе матери при беременности в первую очередь направлены на обеспечение развития антигенно-чужеродного плода, который является аллотрансплантатом для организма матери. Ключевым моментом в развитии нормальной беременности считается распознавание чужеродных антигенов зародыша, кодируемых генами главного (большого) комплекса (локуса) гистосовместимости.
Изменения, происходящие до 16 нед беременности, направлены на создание благоприятного иммунного фона для имплантации плодного яйца, роста и развития плаценты, а также органогенеза плода. Иммунокомпетентные клетки репродуктивной системы и регионарных лимфатических узлов, реагируя на эмбрион, обеспечивают местный иммунитет матки при беременности. Одновременно происходит развитие общих, системных иммунных реакций.
При распознавании антигенов плода антиген-распознающие материнские клетки, которыми являются Т- и В-лимфоциты, сенсибилизируются по отношению к представленным у плода отцовским антигенам. Однако при физиологическом течении беременности в материнском организме этой реакции не происходит, так как параллельно развиваются иммунные механизмы, ограничивающие активность сенсибилизированных клеток и направленные на подавление эффекторного звена иммунитета к отцовским аллоантигенам плода. Клеточным реакциям, направленным на отторжение плода, препятствуют повышение активности супрессорных лимфоцитов и появление «блокирующих» антител.
Растворимые факторы, определяющие феномен сывороточной супрессии иммунного ответа аутологичных лимфоцитов, являются блокирующими. Поступая в кровь, они вызывают разные иммуносупрессивные эффекты на различных стадиях развития беременности. Блокирующие антитела не вызывают патологических изменений в плаценте и у плода, так как не попадают к плоду и не циркулируют в его крови. В случае снижения в крови беременных содержания «блокирующих» факторов беременность может прерваться.
Перестройка лимфоидных органов при беременности сопровождается мобилизацией супрессорных клеток. В крови беременных циркулируют гуморальные «блокирующие» факторы и супрессорные лимфоциты, неспецифически угнетающие распознавание аллогенных клеток. Супрессорные лимфоциты обнаруживаются в крови женщин начиная с 5—8 нед беременности.
При беременности изменяется соотношение регуляторных субпопуляций Т-лимфоцитов в сторону супрессии: увеличивается количество Т-супрессоров и уменьшается количество Т-хелперов.
У беременных отмечается угнетение функциональной активности лимфоцитов. Супрессорная активность лимфоцитов у женщин с физиологическим течением беременности наиболее выражена в I и II триместрах и ниже в III триместре.
Угнетение специфических иммунных реакций у беременной частично компенсируется усилением факторов неспецифической защиты организма. Происходит активация системы фагоцитов, усиление хемилюминесцентного ответа нейтрофилов и моноцитов. Увеличение продукции активных форм кислорода у беременных способствует противоинфекционной защите.
Плацента играет важную роль в обеспечении иммунологической толерантности матери к плоду, выполняя функцию иммунорегуляторного барьера. Плацента продуцирует различные активные вещества (гормоны, лимфокины), которые угнетают антигенраспознающую функцию Т-лимфоцитов и генерацию цитолитических Т-лимфоцитов. Кроме того, в плаценте концентрируются супрессорные клетки и фиксируются аллоиммунные комплексы.
Функционирование плаценты в качестве иммунологического барьера обусловлено локальными иммунорегуляторными реакциями на границе мать — плод благодаря наличию антигенов гистосовместимости.
Материнские HLA-антитела, связавшись с антигенами, фиксируются на плаценте, что не позволяет им попадать в кровоток плода.
Рецепторы, локализованные в основном на мембранах синцитиотрофобласта, связывают материнские антитела, способствуя их транспорту к плоду и созданию у него пассивного иммунитета. Расположенные в строме плаценты рецепторы при связывании комплексов антиген — антитело защищают плод от опасных ИК. Фиксация антител на плаценте ингибирует активность цитотоксических лимфоцитов.
Отсутствие реакций, направленных на отторжение плода, связывают со способностью клеток трофобласта регулировать экспрессию генов 1-го класса и угнетать экспрессию генов 2-го класса комплекса гистосовместимости. Экспрессия антигенов 2-го класса комплекса гистосовместимости представляет опасность для развития беременности.
В трофобласте с самых ранних сроков беременности вырабатывается множество иммунологически активных веществ. Они оказывают в большей степени локальную, чем системную, иммуносупрессию. Функциональная активность иммунокомпетентных клеток, в частности присутствующих в плаценте, обусловливается секрецией ими цитокинов — медиаторов межклеточного взаимодействия, продуцирующихся в ответ на антигенные или митогенные воздействия, и экспрессией на мембранах клеток рецепторов, отвечающих на продуцируемые белки. Уровень секреции ИЛ-1, с которого начинается процесс продукции иммунорегуляторных цитокинов, при физиологическом течении беременности изменяется в критические периоды развития плода. Отмечено снижение продукции ИЛ-1 в сроки 7—8 и 12—16 нед беременности и увеличение в сроки 6—8, 18—25 и 38—40 нед беременности.
Важная роль в предотвращении отторжения плода придается иммуносупрессивному белку ТУ6. Этот белок вызывает антипролиферативный эндокринный эффект и вызывает апоптоз клеток, его экспрессирующих. Мембранная форма этого белка включается в процессы апоптоза, а растворимая форма поддерживает иммунную супрессию и толерантность с помощью цитокиноподобной активности.
Одним из важнейших медиаторов при беременности является ИЛ-2, который необходим для нормального течения процессов, связанных с плацентацией, так как участвует в созревании и функционировании клеток трофобласта. Достоверное снижение экспрессии рецепторов к ИЛ-2 (без нарушения продукции самого ИЛ-2) зарегистрировано в I триместре беременности.
К числу иммуносупрессивных полипептидов, продуцируемых клетками репродуктивной системы, относится фактор некроза опухоли (ФНО), который обнаруживается в больших количествах в период раннего органогенеза.
Таким образом, в изменения иммунной системы, возникающие в организме беременной, вовлекается как клеточное, так и гуморальное ее звено. Могут изменяться количественные показатели иммунокомпетентных клеток и их функциональные свойства, активируются супрессорные механизмы, продуцируются «блокирующие» факторы.
Среди факторов, обеспечивающих иммунологическую защиту плода и нормальное течение беременности, значительную роль играют фибриноидный и сиаловый слои, которые регулируют процессы перехода антител к внутренним структурам плаценты, что препятствует инвазии цитотоксических Т-клеток.
В самые ранние сроки после оплодотворения плодное яйцо начинает вырабатывать фактор ранней беременности, регулирующий процесс имплантации бластоцисты и обладающий иммуносупрессивным действием.
В системной супрессии иммунитета принимает участие ряд гормонов, уровни которых во время беременности значительно повышены.
Хорионический гонадотропин (ХГ) обладает иммуносупрессивными свойствами в отношении пролиферации лимфоцитов. Кроме того, он изменяет функциональную активность клеток моноцитарно-макрофагального ряда.
Плацентарный лактоген, являясь одним из основных гормонов беременности, обладает способностью угнетать пролиферативный ответ Т- и В-лимфоцитов на митогены.
Прогестерон и эстрогены оказывают локальное паракринное иммуносупрессивное действие на цитотоксические клетки. Этот эффект предотвращает раннюю сенсибилизацию матери к отцовским антигенам, которые экспрессируются позже на трофобласте.
С ранних сроков беременности плацента продуцирует множество белков. Из плаценты выделен ряд белков — трофобластический гликопротеид, α2-микроглобулин фертильности, плацентарный α1-микроглобулин, обладающих иммуносупрессивной активностью.
Таким образом, эволюционно-приспособительные механизмы, позволяющие вынашивать аллогенный плод, обусловлены взаимодействием между иммунной системой матери, плацентой и гуморальными факторами, включая антитела, медиаторы межклеточного взаимодействия, белки и гормоны.
Пищеварительная система. Функция печени
При беременности отмечается гипотония желудочно-кишечного тракта как вследствие соответствующих нейрогормональных изменений, так и в результате топографического воздействия со стороны увеличивающейся в размерах матки.
Увеличенная матка вызывает смещение желудка и кишечника. Желудок в отличие от его естественной горизонтальной позиции приобретает вертикальное положение, смещается кверху и кзади. Снижается его тонус, затрудняется эвакуация пищи. Механические факторы ведут к повышению внутрижелудочного давления и смещению угла гастроинтестинального соединения кпереди, что увеличивает вероятность рефлюкса.
Вследствие гипотонического воздействия прогестерона на гладкую мускулатуру кишечника у беременных нередко отмечаются запоры. Увеличивается всасывание в кишечнике микроэлементов, воды, питательных веществ.
В первые месяцы беременности отмечается увеличение аппетита, что позже становится обычным явлением. Нередко наблюдаются различные вкусовые извращения или появляются определенные вкусовые прихоти, что связано с гормональными изменениями, а также со снижением секреторной функции желудочно-кишечного тракта. Может иметь место изжога, тошнота или рвота.
Со стороны печени гистологических изменений нет. Однако происходит увеличение ее функциональной активности. Изменяется интенсивность липидного обмена, что выражается развитием липемии, холестеринемии, значительным снижением в крови содержания эфиров холестерина, что свидетельствует о повышении синтетической функции печени.
Отмечается снижение количества гликогена в печени, что обусловлено интенсивным переносом глюкозы из организма матери к плоду.
Изменяется и белковообразующая функция печени, что становится значительно выраженным со второй половины беременности, когда происходит снижение концентрации общего белка в крови до 60 г/л. При этом отмечается снижение концентрации альбуминов и повышение уровня глобулинов.
Происходит также увеличение активности АсАТ, щелочной фосфатазы. В конце беременности повышается содержание билирубина в сыворотке крови.
Усиливаются также процессы инактивации эстрогенов и других стероидных гормонов, синтезируемых плацентой. Незначительно снижается детоксикационная функция печени.
Беременность предрасполагает к возникновению нарушений со стороны желчного пузыря. Прогестерон оказывает релаксирующее влияние на сфинктер желчного пузыря. При этом снижается перистальтика желчевыводящих путей, что приводит к нарушению оттока желчи из желчного пузыря, застою желчи. Происходящие изменения приводят к холестазу, что создает благоприятные условия для развития холелитиаза.
Мочевыделительная система
У беременных женщин отмечается увеличение почек, размер по длине возрастает на 1,5—2 см и достигает 9—12 см. Уже в начале беременности чашечно-лоханочная система расширяется в связи с гиперпрогестинемией. Дилатация может достигать значительных размеров и, как правило, бывает асимметричной, обычно больше выражена справа. Расширение верхних отделов мочевых путей является фактором, способствующим развитию мочевой инфекции и пиелонефрита у беременных.
Уже в ранние сроки беременности возрастают скорости почечного кровотока (на 25—35 %) и клубочковой фильтрации (на 35—50 %), снижаясь только непосредственно перед родами [Шрайер Р. В., 1997]. Изменения почечной гемодинамики сопровождаются снижением сывороточного уровня продуктов азотистого метаболизма.
Нормальные значения концентрации креатинина во время беременности не превышают 70 мкмоль/л, азота мочевины — 43 ммоль/л, мочевой кислоты — 0,27 ммоль/л. Нормальные значения скорости клубочковой фильтрации, рассчитанные по формуле Кокрофта, у беременных составляют 120—150 мл/мин.
Увеличение скорости клубочковой фильтрации не сопровождается повышением канальцевой реабсорбции, поэтому во время беременности в моче могут появляться различные вещества, которые отсутствуют в ней у небеременных женщин. Так, иногда развиваются физиологическая протеинурия и глюкозурия. Уровень физиологической протеинурии у беременных при использовании количественных методов ее определения (измерение оптической плотности на фотоэлектроколориметре после добавления сульфосалициловой кислоты) не превышает 0,3 г/сут. Что касается глюкозурии, то ее значения могут достигать высоких цифр без существенных изменений концентрации глюкозы в крови. У беременных увеличивается экскреция бикарбонатов. Это компенсаторная реакция в ответ на развитие дыхательного алкалоза вследствие физиологической гипервентиляции. Моча приобретает устойчивую щелочную реакцию. Щелочная реакция мочи не является проявлением мочевой инфекции, хотя может способствовать ее развитию.
Наиболее существенные изменения происходят в сфере водно-солевого гомеостаза. Вследствие гормональных изменений, прежде всего гиперпродукции минералокортикостероидов, в организме беременной женщины задерживаются натрий и вода. К концу беременности суммарное накопление натрия достигает максимальных значений, что соответствует задержке жидкости до 6 л. Две трети этого количества натрия и его объемного эквивалента распределяются в организме плода, а одна треть — в организме матери. В организме матери натрий накапливается во внеклеточном пространстве равномерно в интерстициальной ткани и сосудистом русле. Ткани становятся гидрофильными, а внутрисосудистый объем возрастает.
Из-за склонности беременных женщин к задержке натрия и воды у них могут развиваться физиологические отеки, особенно после провоцирующих факторов (злоупотребление солью, физическая перегрузка, жаркая погода). Отличие физиологических отеков от патологических состоит в их эфемерности. Такие отеки нестойкие и легко исчезают после устранения провоцирующего фактора или в состоянии физического покоя, особенно в положении на левом боку. Это положение оптимально для работы почек и способствует улучшению пассажа мочи по мочевым путям. Физиологические отеки развиваются в различные периоды беременности примерно у 80 % здоровых женщин и не требуют специального лечения [Robertson E. G., 1971].
Другим следствием задержки натрия и воды является феномен разведения крови. Увеличение объема плазмы приводит к снижению гематокритного числа, которое не превышает 35—36 %. Отмечается относительное снижение числа эритроцитов и концентрации гемоглобина в крови, что часто симулирует развитие анемии. Нормальные значения гемоглобина крови у беременных составляют 100—120 г/л. Примерно на 10 г/л уменьшается сывороточная концентрация общего белка (45—75 г/л) и альбумина (25—45 г/л). Относительное снижение содержания белка в сосудистом русле может способствовать развитию физиологических отеков.
Эндокринная система
С самого начала беременности происходит торможение циклической гонадотропной функции гипофиза.
Гормоны периферических эндокринных желез находятся преимущественно в связанном состоянии. Эндокринная функция организма беременной обеспечивается в первую очередь плацентой.
Передняя доля гипофиза увеличивается во время беременности в 2—3 раза. Происходит выраженное снижение ФСГ и ЛГ.
В противоположность гипофизарным гонадотропинам уровень циркулирующего в крови матери пролактина начинает повышаться уже в I триместре и ко времени родов в 10 раз превышает уровень, наблюдающийся до беременности. Основным стимулятором продукции пролактина являются, вероятно, эстрогены, секреция которых плацентой нарастает по мере увеличения сроков беременности. При этом выявлена гиперплазия и гипертрофия лактотрофов гипофиза матери.
Концентрация гипофизарного соматотропного и тиреотропного гормонов сохраняется практически такой же, как и до наступления беременности.
На фоне беременности весь метаболизм в организме, в том числе и функция щитовидной железы, изменяется для обеспечения возрастающих потребностей развивающегося плода. Изменение функционирования щитовидной железы происходит уже с первых недель беременности и проявляется увеличением ее размеров и продукции тиреоидных гормонов на 30—50 %. Такое состояние расценивают как физиологический гипертиреоз, развивающийся в результате гиперстимуляции щитовидной железы (схема 1).
Схема 1. Изменение функционирования щитовидной железы во время беременности
Наиболее мощным стимулятором ее в первой половине беременности является хорионический гонадотропин (ХГ), схожий по своей структуре с тиреотропным гормоном гипофиза (ТТГ) за счет общей α-субъединицы и в больших количествах способный оказывать ТТГ-подобное действие. Увеличение продукции тиреоидных гормонов по механизму отрицательной обратной связи обусловливает подавление продукции ТТГ, который в норме в первой половине беременности снижен у 20 % женщин. Однако при многоплодной беременности, когда уровень ХГ в крови повышен значительно, продукция ТТГ гипофиза подавляется в 100 % случаев. Далее по мере увеличения срока беременности происходит снижение количества ХГ и уровень ТТГ возвращается к нормальным значениям, в то время как уровень тиреоидных гормонов остается повышенным до конца беременности и снижается непосредственно перед родами.
Помимо выработки ХГ, на фоне развивающейся беременности происходит увеличение продукции эстрогенов, стимулирующих образование в печени тироксинсвязывающего глобулина (ТСГ). Кроме того, увеличивается связывание ТСГ с сиаловыми кислотами, что значительно снижает его клиренс. В результате к 18— 20-й неделе уровень ТСГ удваивается и приводит к связыванию дополнительного количества свободных тиреоидных гормонов. Транзиторное снижение уровня последних вызывает дополнительную стимуляцию щитовидной железы со стороны ТТГ, в результате чего количество свободных фракций Т4 и Т3 в кровотоке сохраняется на нормальном уровне, тогда как уровень общих (связанных + свободных) Т4 и Т3 у всех беременных женщин в норме повышен. Физиологический смысл этого феномена заключается, возможно, в том, что в организме беременной создается дополнительный резерв тиреоидных гормонов.
Формирование и функционирование фетоплацентарного комплекса приводит к отвлечению на себя части гормонов щитовидной железы и йода. В плаценте функционируют дейодиназы. Среди них наибольшей активностью обладает 5-дейоди-наза III типа, катализирующая дейодирование матери до реверсивного Т3, который в высокой концентрации содержится в амниотической жидкости, и трансформацию Т3 в Т4 (дийодтирозин), т. е. превращает активные тиреоидные гормоны в биологически неактивные метаболиты. Высвобождающийся в этой реакции йод может переноситься к плоду и использоваться для синтеза его тиреоидных гормонов. Активное дейодирование тиреоидных гормонов матери и дополнительная потеря йода также служат косвенным стимулятором гормонпродуцирующей функции щитовидной железы. Кроме того, на фоне беременности постепенное увеличение объема почечного кровотока и гломерулярной фильтрации приводит к увеличению экскреции йода с мочой, что также обусловливает косвенную стимуляцию щитовидной железы.
Во время беременности происходит повышение функциональной активности коркового вещества надпочечников, что связано с секрецией плацентой адренокортикотропного гормона (АКТГ) и кортизоноподобных веществ. Увеличивается количество суммарных (свободных и связанных) кортикостероидов. Это обстоятельство обусловлено тем, что под воздействием эстрогенов в печени усиливается синтез глобулинов, связывающих кортикостероиды, что приводит к уменьшению их утилизации. Кроме того, во время беременности повышается чувствительность к существующему уровню АКТГ.
Плацента проницаема для кортикостероидов как материнского, так и плодового происхождения.
Обмен веществ
Во время беременности происходит активация всех метаболических процессов, чтобы обеспечить растущие потребности плода, плаценты, матки, а также базальный уровень метаболизма матери.
В процессе развития беременности происходит интенсификация белкового обмена и накопление белковых субстанций в организме для обеспечения растущего плода и жизнедеятельности организма матери пластическим материалом.
Активируется обмен жиров, о чем свидетельствует повышение уровня липидов в сыворотке крови.
Изменяется и метаболизм углеводов. Происходит накопление гликогена в печени, мышцах, матке и плаценте. Метаболические потребности плода покрываются усиленным потреблением глюкозы. В ответ на это увеличивается секреция инсулина.
Начиная с 15 нед беременности уровень глюкозы у беременных после ночного голодания значительно ниже, чем у небеременных женщин. Оптимальным для беременных является уровень глюкозы 4,4—5,5 ммоль/л. У здоровых небеременных женщин признаки гипогликемии обычно появляются при уровне глюкозы ниже 2,2 ммоль/л. У беременных гипогликемия определяется, когда содержание глюкозы в крови уже ниже 3,3 ммоль/л. Гипогликемия стимулирует высвобождение глюкагона, кортизола и, что важно, катехоламинов.
Выраженные изменения претерпевает минеральный обмен. В организме беременной происходит задержка солей кальция и фосфора, которые затем поступают к плоду и расходуются на построение его костей.
Концентрация железа в сыворотке крови беременной по мере развития беременности снижается, составляя 21 мкмоль/л в I триместре, 14,6 мкмоль/л во II триместре и 10,6 мкмоль/л в III триместре. Снижение концентрации железа обусловлено рядом причин: увеличением ОЦП, возрастающим общим объемом эритроцитов, переходом железа к плоду для синтеза фетального гемоглобина.
В организме матери происходит также задержка калия, натрия, магния, меди. Все эти элементы принимают активное участие в обмене веществ.
При физиологическом течении беременности характерным является задержка жидкости в организме. Изменения водного обмена характеризуются повышением онкотического и осмотического давления в тканях, что обусловлено задержкой альбуминов и натрия. Создаются условия для накопления жидкости в тканях. При этом несколько увеличивается объем внутриклеточной жидкости и в основном возрастает объем внеклеточной жидкости, прежде всего ОЦК. Регуляция водного обмена в первую очередь осуществляется за счет воздействия альдостерона, прогестерона и АДГ.
Для обеспечения нормального течения беременности возрастает интенсивность потребления витаминов, которые необходимы для обеспечения обменных процессов в организме матери и плода. Витамин Е принимает участие в правильном развитии беременности. Интенсивность потребления железа для синтеза гемоглобина обеспечивается достаточным количеством витаминов С, В,, В2, В12, РР и фолиевой кислоты.
Витамины не синтезируются в организме и поступают только извне с продуктами питания.
Определенные изменения наблюдаются со стороны КОС, что проявляется в виде физиологического метаболического ацидоза и дыхательного алкалоза.
Изменения со стороны крови
Среди многочисленных изменений, происходящих со стороны крови во время беременности, следует отметить увеличение ОЦК. Увеличение этого показателя начинается с 10 нед беременности, постоянно нарастает и достигает своего пика в 36 нед, составляя 25—50 % от исходного уровня. Наибольшее увеличение ОЦК сопровождается процессом роста плаценты в I и во II триместрах. Увеличение ОЦК связано с возрастанием объема маточно-плацентарного круга кровообращения, увеличением массы молочных желез и объема венозного русла.
Прирост ОЦК происходит в основном за счет увеличения ОЦП и в меньшей степени за счет объема и количества эритроцитов. Так, объем плазмы возрастает на 35—50 % в сравнении с исходным уровнем, а количество эритроцитов, только на 12—15 %. Возникающая при этом диспропорция сопровождается тем, что в 26—32 нед происходит относительное снижение количества эритроцитов и содержания гемоглобина, несмотря на их абсолютное увеличение. Это приводит к возникновению олигоцитемической гиповолемии и снижению вязкости крови.
Соотношение между приростом ОЦП и общим объемом эритроцитов, циркулирующих в крови, отражает показатель гематокритного числа, который во время беременности колеблется от 30 до 36 %.
Вследствие неравнозначного прироста ОЦП и количества эритроцитов развивается физиологическая анемия, которая характеризуется снижением гематокритного числа до 30 % и снижением уровня гемоглобина. Уменьшение содержания гемоглобина до 110 г/л является нижней границей нормы для беременных.
В отличие от эритроцитов количество лейкоцитов во время беременности увеличивается в основном за счет возрастания количества нейтрофилов.
В табл. 5.5 представлены изменения гематологических показателей во время беременности.
Во время беременности в системе гемостаза происходят адаптационные изменения, с одной стороны, направленные на создание условий для быстрой остановки кровотечения, а с другой — на оптимизацию маточно-плацентарного и плодово-плацентарного кровотока.
Происходит повышение активности факторов свертывания крови, особенно фибриногена. Фибрин откладывается на стенках сосудов маточно-плацентарного комплекса. Отмечается снижение активности фибринолиза.
Тромбоциты играют важную роль в системе гемостаза. Значительного изменения их количества при нормальном течении беременности не происходит. Процесс тромбообразования с участием тромбоцитов, с одной стороны, регулируется простациклином, который продуцируется сосудистой стенкой, является вазодилататором и ингибитором агрегации тромбоцитов, а с другой стороны — тромбоксаном, который является вазоконстриктором и активирует агрегацию тромбоцитов. При нормальном течении беременности существует баланс между простациклином и тромбоксаном.
Таблица 5. Изменения гематологических показателей во время беременности
| Показатели | Небеременные | I триместр | II триместр | III триместр |
| ОЦК, мл/кг | 65,7 ± 2,3 | 74,2 ± 4,3 | 81,1 ±4,4 | 85,0 ± 4,6 |
| Объем плазмы, мл/кг | 40,9 ± 1,2 | 47,1 ± 2,2 | 50,8 ± 3,0 | 51,9 ± 2,0 |
| Эритроциты, •1012/л | 4,2 ± 0,05 | 4,1 ± 0,07 | 4,0 ± 0,07 | 3,8 ± 0,07 |
| Гемоглобин, г/л | 130,8 ± 2,6 | 128,0 ± 2,8 | 122,0 ± 2,6 | 120,0 ± 2,3 |
| Гематокритное число, % | 35 | 33 | 36 | 36 |
| Лейкоциты, •109/л | 7,4 | 10,2 | 10,5 | 10,4 |
| Нейтрофилы, % | 55 | 66 | 69 | 69,6 |
| Базофилы, % | 0,5 | 0,2 | 0,2 | 0,1 |
| Эозинофилы, % | 2,0 | 1,7 | 1,5 | 1,5 |
| Лимфоциты, % | 38,0 | 27,9 | 25,2 | 25,3 |
| Моноциты, % | 4,0 | 3,9 | 4,0 | 4,5 |
| СОЭ, мм/ч | 22 | 24 | 45 | 52 |
Таблица 6. Изменения показателей системы гемостаза во время беременности
| Показатели | Небеременные | I триместр | II триместр | III триместр |
| Фибриноген, г/л | 3,01 ± 0,38 | 2,98 ± 0,28 | 3,11 ±0,31 | 4,95 + 0,62 |
| АЧТВ, с | 41,5 ± 3,8 | 39,2 ± 4,1 | 36,5 ± 2,1 | 34,1 ± 2,5 |
| АВР, с | 65,0 ± 5,0 | 64,4 ± 6,9 | 61,4 ± 5,9 | 51,1 ±4,8 |
| Протромбиновый индекс, % | 86,5 ± 3,4 | 89,3 ± 4,5 | 95,4 ± 5,3 | 108,8 ± 3,3 |
| ПДФ, мкг/мл | До 2,0 | До 2,0 | До 2,0 | 5,7 ± 0,9 |
| Антитромбин III, г/л | 0,25 ± 0,022 | 0,222 ± 0,032 | 0,175 ± 0,013 | 0,15 ± 0,019 |
| Тромбоциты, •109/л | 295 ± 32 | 302 ± 14,5 | 288 ± 12 | 250 + 14 |
В процессе нормального течения беременности, начиная с 12—13 нед, отмечается повышение уровня ряда факторов свертывания крови (VII, VIII, X) и увеличение уровня фибриногена в плазме.
Снижается активность ингибиторов свертывания крови, к которым относятся антитромбин III и протеин С.
Фибринолитическая активность плазмы снижается и становится наименее выраженной в родах. В торможении процесса фибринолиза важную роль играет плацента.
Изменения показателей системы гемостаза во время беременности представлены в табл. 6.